相平衡及相图.pdf
- 文件大小: 504.12KB
- 文件类型: pdf
- 上传日期: 2025-08-25
- 下载次数: 0
概要信息:
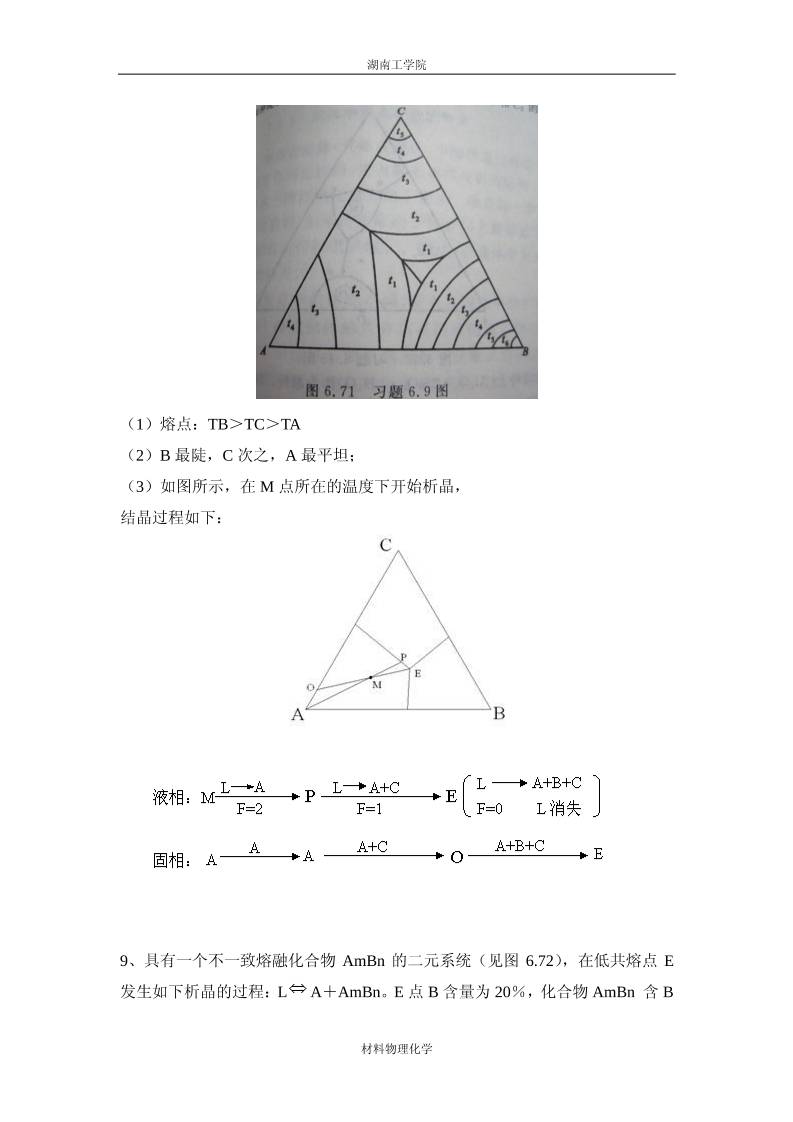
湖南工学院 材料物理化学 第六章 相平衡与相图 1、什么是平衡状态?影响平衡的因素有哪些? 解:平衡态:不随时间而发生变化的状态称为平衡状态。影响平衡的因素有: 温度、压力、组分浓度等。 2、什么是凝聚系统?什么是介稳平衡? 解:凝聚系统:不含气相或气相可以忽略的系统。介稳平衡:即热力学非 平衡态,能量处于较高状态,经常出现于硅酸盐系统中。 3、简述一致熔化合物与不一致熔化合物各自的特点。 解:一致熔化合物是指一种稳定的化合物。它与正常的纯物质一样具有固 定的熔点,熔化时,所产生的液相与化合物组成相同,故称一致熔融。 不一致熔化合物是指一种不稳定的化合物。加热这种化合物某一温度便发生分 解,分解产物是一种液相和一种晶相,二者组成与化合物组成皆不相同,故称不 一致熔融。 4、比较各种三元无变量点(低共熔点、双升点、双降点、过渡点和多晶转变点) 的特点,写出它们的相平衡关系。 解:低共熔点:是一种无变量点,系统冷却时几种晶相同时从熔液中析出, 或加热时同时融化。 E L A S C 双升点:处于其相应的副三角形的交叉位的单转熔点。 P L A B S 双降点:处于其相应的副三角形的共轭位的双转熔点。 R L A B S 5、简述 SiO2 的多晶转变现象,说明为什么在硅酸盐产品中 SiO2 经常以介稳 状态存在? 解:在 573℃以下的低温,SiO2 的稳定晶型为 b -石英,加热至 573℃转变 为高温型的 a -石英,这种转变较快;冷却时在同一温度下以同样的速度发生 逆转变。如果加热速度过快,则 a -石英过热而在 1600℃时熔融。如果加热速 度很慢,则在 870℃转变为 a -鳞石英。a -鳞石英在加热较快时,过热到 1670℃ 时熔融。当缓慢冷却时,在 870℃仍可逆地转变为 a -石英;当迅速冷却时,沿 虚线过冷,在 163℃转变为介稳态的 b -鳞石英,在 117℃转变为介稳态的 g - 湖南工学院 材料物理化学 鳞石英。加热时 g -鳞石英仍在原转变温度以同样的速度先后转变为 b -鳞石 英和 a -鳞石英。a -鳞石英缓慢加热,在 1470℃时转变为 a -方石英,继续 加热到 1713℃熔融。当缓慢冷却时,在 1470℃时可逆地转变为 a -鳞石英;当 迅速冷却时,沿虚 线过冷,在 180~270℃转变为介稳状态的 b -方石英;当加 热 b -方石英仍在 180~270℃迅速转变为稳定状态的 a -方石英。熔融状态的 SiO2 由于粘度很大,冷却时往往成为过冷的液相--石英玻璃。虽然它是介稳 态,由于粘度很大在常温下可以长期不变。如果在 1000℃以上持久加热,也会 产生析晶。熔融状态的 SiO2,只有极其缓慢的冷却,才会在 1713℃可逆地转变 为 a -方石英。对 SiO2 的相图进行分析发现,SiO2 的所有处于介稳状态的熔体 的饱和蒸汽压都比相同温度范围内处于热力学稳定态的熔体的饱和蒸汽压高。而 理论和实践证明,在给定的温度范围,具有最小蒸汽压的相一定是最稳定的相。 所以由于晶型转变速度不同,在不同的加热或冷却速率下,硅酸盐制品中经常出 现介稳态晶相。 6、如图 6.69 所示为钙长石(CaAl2Si2O8)的一元系统相图。请回答: (1)六方和正交钙长石的熔点各约为多少? (2)三斜与六方晶型的转变是可逆的还是不可逆的? (3)正交晶型是热力学稳定态,还是介稳态? 解:(1)六方钙长石熔点约 1300℃(B 点),正交钙长石熔点约为 1180℃(C 点)。(2)三斜与六方晶型的转变是可逆的。因为六方晶型加热到转变温度会转 变成 三斜晶型,而高温稳定的三斜晶型冷却到转变温度又会转变成六方晶 型。 湖南工学院 材料物理化学 (3)正交晶型是介稳态。 7、写出图 6.70 中三元材料 x,y 的成分,将成分为 x 的材料 300g 与成分分为 y 的材料 200g 熔化在一起,形成一个新的材料,请用作图法求出新材料的成分, 并用计算法进行验证。 解:由杠杆规则,新材料组成点在 xy 线上,设新组成材料为 z,则: xz/yz=200/300=2/3 xz:yz=2:3 8、根据图 6.71 所示的投影图回答下列问题: (1)A、B、C 三个组元的熔点的高低次序怎样排列? (2)各液相面下降的陡峭程度如何?哪一个最陡,哪一个最平缓? (3)指出组成为 65%A、15%B、20%C 的体系的相组成点,并描述其结晶过程。 湖南工学院 材料物理化学 (1)熔点:TB>TC>TA (2)B 最陡,C 次之,A 最平坦; (3)如图所示,在 M 点所在的温度下开始析晶, 结晶过程如下: 9、具有一个不一致熔融化合物 AmBn 的二元系统(见图 6.72),在低共熔点 E 发生如下析晶的过程:L A+AmBn。E 点 B 含量为 20%,化合物 AmBn 含 B 湖南工学院 材料物理化学 量为 64%,今有 C1 和 C2 两种配料,其配料点分置于 E 点两侧。已知 C1 中 B 含 量是 C2 中 B 含量的 1.5 倍,且在达低共熔点温度前的冷却析晶过程中,从这两 种配料中析出的初晶相含量相等。试计算 C1和 C2 的组成。 解:设 A-B 二元相图中组成以质量百分数表示。C1 和 C2 两种配料量均为 G(kg)。据题意,初相在低共溶点前析出,则 C1 和 C2 二配料组成必在 AP 之间 (若在 PB 之间,初相比在转熔点 P 前析出)。又该二配料组成不同,而析出的 初相含量相等,可知二配料点一定分置于低共溶点 E 两侧,析出初相分别为 AmBn 和 A。 设 C1 含 B 的量为 x%, C2 含 B 量为 y%, 则根据杆杠规则可以建立下面方程: 解联立方程,得 x=26%,y=17.3%。 所以,C1 组成为含 B 的量 26%,C2 组成为含 B17.3% 10、已知 A 和 B 两组成构成具有低共熔点的有限固溶体的二元系统。试根据下 列实验数据绘制概略相图。已知 A 的熔点为 1000℃,B 的熔点为 700℃。含 B 为 0.25mol 的试样在 500℃完全凝固,其中含 0.733mol 初相 SA(B)和 湖南工学院 材料物理化学 0.267mol[SA(B)+SB(A)]共生体。含 B 为 0.5mol 的试样在同一温度下凝固 完毕,其中含 0.4mol 初相 SA(B)和 0.6mol[SA(B)+SB(A)]共生体,而 SA(B)相总量占晶相总量的 50%。实验数据均在达到平衡状态时测定。 解:因 a、b 点温度及低共熔温度已知,欲绘此相图之草图,关键是求出 C、 E、D 三点之组成。由于二个试样析出初晶相均为 SA(B),且在同一温度下凝 固完毕(此温度显然即低共熔温度,可知该二试样的组成必都落在 CE 间。) 设 C 点含 B 量为 x, E 点含 B 量为 z。根据题意借助杠杆规则可以获得下面关系 式。 解上述联立方程,得 x=0.051,y=0.799,z=0.949, 据此,可确定 C 点含 B 量 0.05mol, E 点含 B 量为 0.80mol, D 点含 B 量为 0.95mol。这样相图中 C、E、D 位置可以 找到,从而绘出相图的草图如下: 湖南工学院 材料物理化学 11、在三元系统的浓度三角形上画出下列配料的组成点,并注意其变化规律。 (1)A=10%, B=70%, C=20% (2)A=10%, B=20%, C=70% (3)A=70%, B=20%, C=10% 今有配料(1)3kg,配料(2)2kg,配料(3)5kg,若将此三配料混合加热至完 全熔融,试依据杠杆规则用作图法求熔体的组成。 解:根据题中所给条件,在浓度三角形中找到三个配料组成点的位置。连接 配料(1)与配料(2)的组成点,按杠杆规则求其混合后的组成点。再将此点与 配料(3)的组成点连接,此连线的中点即为所求的熔体组成点。 12、试完成图 6.73上的配料点 1、2、3的结晶路程(表明液、固相组成点的变 化及结晶过程在各阶段系统中发生的变化)。 湖南工学院 材料物理化学 m n m n m n L A BL m n m n m n m nP = 1 f 3 P 2 , f 2 L A B B L A B B C m n m nP 3 , f 1 P 4 , f 0 1[ A B , ( A B )] a [ A B , A B ( B )] E [ b , A B B + (C )] E [1, A B B + C ] , 熔 体 1 ( 液 相 消 失 ) m n L L A L A C P = 1 f 3 P 2 , f 2 P 3 , f 1 L A B A C m n m nP 4 , f 0 2 2[ A , ( A )] h [ A , A (C )] P [g , ( A B ) B + A ] [ 2 , A B A + C ] , 熔 体 P( 液 相 消 失 ) m n m n m n m n L L A m nP = 1 f 3 P 2 , f 2 L A A B L A B m n m n m n m nP 3 , f 1 P 2 , f 2 L A B C L A B B C m n m nP 3 , f 1 P 4 , f 0 2[ A , ( A )] C [ A , ( A B ) + A ] d ( A )[ A B , A B ] e[ A B , A B + ] E [ f , A B ( B ) + C ] E [3, A B B + , 熔 体 3 消 失 ( C) ( 液 相 消 失 ) C ] 13、如图 6.74所示为生成一个三元化合物的三元系统相图。 (1)判断三元化合物 N的熔融性质; (2)标出界线上的温降方向(转熔界线用双箭头); (3)指出无变量点 K、L、M的性质; (4)分析点 l、2的结晶路程(表明液固组成点的变化及各阶段的相变化)。 湖南工学院 材料物理化学 (1)N化合物组成点处于初晶区外,为不一致熔融三元化合物。 (2)用连线规则(最高温度规则)和切线规则判断边界曲线性质(共熔和转熔) 及温度下降方向。(如图所示) 生成三元化合物 N 的 A-B-C 三元相图 (3)用重心位规则判断三元无变点的性质。M和 L为低共熔点。K为单转熔点。 (4)1,2点的结晶路程: L L N L N C 1 1[ N , ( N )] a [ N , N (C )] P 1, F 3 P 2 , F 2 P 3, F 1 L N C B L[ h , N C ( B )] L ( [1, N B C ] P 4 , F 0 熔 体 液 相 消 失 ) 湖南工学院 材料物理化学 L L B L A B 2 2[ B , ( B )] P [ B , B ( A )] P 1 F 3 P 2 , F 2 P 3, F 1 L A N B L N B K [ d , A B ( N )] K ( A [ f , N B ] P 4 , F 0 P 3, F 1 L N C B L [ g , N B ( C )] L ( [ 2 , N B C ] P 4 , F 0 熔 体 , 消 失 ) 液 相 消 失 ) 14、A-B-C三元系统相图如图 6.75所示,图中有一个三元化合物 D(AmBn)和一 个三元化合物 M(AxByCz).要求: (1)将该图划分为若干个子三角形,并写出子三角形名称; (2)标注各界线上温度下降方向,转熔界线用双箭头; (3)写出途中 o、w、u、v点的相平衡关系式; (4)写出组成点 1的第一结晶相和最终产物; (5)画出 A-B二元相图并标明各区相态。 解:(1)子三角形的划分如图中虚线所示。子三角形名称:△ABM,△BMC, △AMC (2)界线上温降方向如图所示。 (3)o、w、u、v点的我相平衡关系式 湖南工学院 材料物理化学 L o D A B w L A M B v L B C M u L A M C 点 : 点 : 点 : 点 : (4)组成点 1的第一结晶相是 A,最终产物是 B+C+M (5)A-B二元相图如图所示 。
缩略图:
当前页面二维码






 工程招标采购
工程招标采购 搞笑表情
搞笑表情 微信头像
微信头像 美女图片
美女图片 APP小游戏
APP小游戏 PPT模板
PPT模板