陆佩文《无机材料科学基础》考点讲义.pdf
- 文件大小: 4.36MB
- 文件类型: pdf
- 上传日期: 2025-08-25
- 下载次数: 0
概要信息:
目 录
绪论 (1)
!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
第三章 熔体与非晶态固体 (3)
!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
第四章 晶体中的点缺陷和线缺陷 (23)
!!!!!!!!!!!!!!!!!!!!!!!!!
第六章 相平衡与相图 (37)
!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
第七章 固体中质点的扩散 (71)
!!!!!!!!!!!!!!!!!!!!!!!!!!!!
第八章 固态化学反应 (81)
!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
第九章 固态相变 (87)
!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
第十章 固态烧结 (99)
!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
陆佩文《无机材料学基础》考点精讲及复习思路
1
绪论
一、教材版本说明
曾燕伟主编,陆佩文主审,《无机材料科学基础》,武汉理工大学出版社,2011年。
其他参考书目
书名 出版社 作者
无机材料物理化学 武汉理工大学出版社 周亚栋
无机材料科学基础教程 化学工业出版社 胡志强
无机材料科学基础 华东理工大学出版社 张其士
无机材料科学基础 化学工业出版社 潘群雄
材料科学基础 上海交通大学出版社 胡赓祥
二、考情分析及命题规律总结
1.试题构成与特点
试题一般分为名词解释、问答、计算题三大部分,有个别学校还有填空题、选择题及判断题,试卷总分150分。试
题难度适中,难题、偏题较少,但有一部分题型需结合生产实际用理论加以解释。其中名词解释约占20~30分(一般
10道),简答占60分左右(一般6~10道),计算题20分左右(一般1~2道),二元相图或三元相图10~20分左右(一
般1~2道),结合实际进行理论分析的问答题大约占40分左右。计算部分涉及到“缺陷浓度”、“固溶体密度”、“结构
参数”、“晶粒大小”等方面的知识,不是很多,主要考点还是集中在问答形式的类型题。一定要注意将本门课程与工艺
学联系到一起解答问题。
2.教材基本内容与考题权重分析
本教材根据无机非金属材料工程、材料物理和材料化学等专业对材料科学基础知识的需要而编写的,结合了无机
非金属材料学科和相关专业的特点,着重讲述无机材料从原料到最终制品的热力学及动力学的基本理论及其工程
应用。
2
全书包括无机材料的化学键与电子结构、晶体的结构与常见晶体结构类型、熔体与非晶态固体、晶体中的点缺陷
与线缺陷、表面与界面、相平衡与相图、固体中质点的扩散、固态化学反应、固态相变及固态烧结这几个部分。在试卷
中,各章节中基本概念、名词解释和基本理论的理解以名词解释和简答形式考查,占50~80分左右。问答题占的比重
非常大,而且很多情况下需要将这门课程的理论与其他课程的内容联系起来,为此,需要对这门课程中的基础理论理
解深刻。教材中无机材料的化学键与电子结构、晶体的结构与常见晶体结构类型以及表面与界面这三章由于与结晶
矿物学和陶瓷工艺学两门课程重复,且其他两门课程对这些内容的介绍更具体与详细,我们在这门课程中就不在复
述。教材中晶体中的点缺陷与线缺陷与固体中质点的扩散和固态化学反应三章联系非常紧密,可能将三章的内容综
合到一起提出问题,相图题几乎是每个学校的必考题,考基础相图题和专业相图题的几率几乎是相同的。相变一章内
容较多,但重点比较突出,而烧结一章基础内容以及与生产实际相结合的考点都比较多,希望考生加以注意。为此,需
要考生依次掌握好各章节重点难点。
3.命题规律总结及命题趋势分析
本门专业课严格按照考研大纲出题,考察重点较为突出,题量和难度适中,怪题、偏题较少。预测今后几年的出题
趋势,应当会较为稳定,与前几年变化不大,新题型很可能就是某些学校将某一个生产实际情况让考生用学过的某一
理论加以解释。
三、备考与应试策略
关于备战复习,要做到“三要三忌”:要抓基础、要注重理解基本概念和方法、要勤于思考和总结;忌死记硬背、忌眼
高手低、忌主次不分明。在复习中要注意对基本概念、原理及一些物理量的计算方法这三方面的重点掌握。
复习过程中①注意透彻理解基本概念、掌握基本原理、灵活运用各种分析方法;②注意拓展思维,充分发挥联想,
深刻体会各章节之间的联系。③动手做题,在练习中领悟知识点、考点以及出题规律之间的关系。重视真题,透彻分
析,全面提高分析问题解决问题的能力。④重视理论与实际结合的题型。
四、要点精讲及复习思路
本阶段我们结构设置如下:
1.本章考情分析:在每章开篇,本章所需掌握的内容有个大概了解,以及本章的常考题型、分值、重要性、重难点
等等。
2.本章基本内容:在每章开篇,介绍本章的基本内容,了解考点重要程度以及考点之间的联系。
3.本章要点精讲:提炼本门课程中的考点和重难点,原则上覆盖考试大纲内容。讲解过程中着重对复习思路进行
引导和强调。
4.本章名校经典试题回顾。
5.本章小结:对本讲内容进行回顾,并针对典型题给出应试技巧。
陆佩文《无机材料学基础》考点精讲及复习思路
3
第三章 熔体与非晶态固体
1.本章考情分析
本章主要介绍了熔体和玻璃体结构的基本理论、性质及转化时的物理化学条件,学会用这些基本理论分析熔体
和玻璃体的结构与性质的变化,并掌握“组成-结构-性能”之间的关系。本章考试中名词解释较少,问答题型较多,
需要在理解基本理论的基础上,针对实际问题进行解答,本章仅涉及一种类型的计算,即结构参数的计算。
2.本章框架结构
本章从两条主线分别介绍了熔体和玻璃体结构的基本理论、性质,然后分别从热力学、动力学、结晶化学三方面介
绍了熔体和玻璃体转化时的物理化学条件,并对几种常见的玻璃类型做了介绍,其中重要的是硅酸盐玻璃和硼酸盐
玻璃。
3.考点精讲
考点一 研究熔体、玻璃的意义
熔体是玻璃制造的中间产物
瓷釉在高温状态下是熔体状态
耐火材料的耐火度与熔体含量有直接关系
瓷胎中40%—60%是玻璃状态(高温下是熔体态)
考点二 能量曲线及XRD分析
气体、熔体、玻璃体和白硅石的XRD图
XRD分析结果:① 熔体和玻璃的结构相似;② 结构中存在着近程有序区。
考点三 熔体的结构
(1)聚合物理论
Ⅰ.聚合物理论的结构描述
4
① 硅酸盐熔体中有多种负离子集团同时存在:如 Na2O—SiO2熔体中有:[Si2O7]
-6(二聚体)、[Si3O
10]-8(三聚
体)……[SinO3n+1]
-(2n+2);
②此外还有“三维晶格碎片”[SiO2]
n,其边缘有断键,内部有缺陷。
平衡时各级聚合物分布呈一定的几何级数。
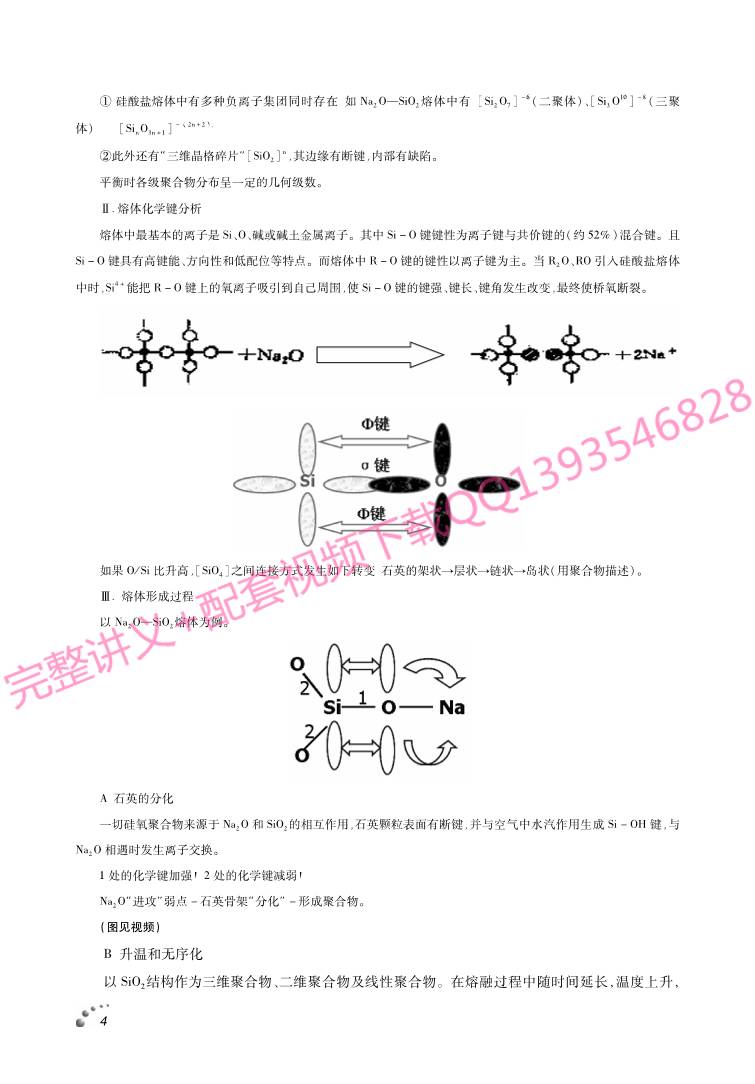
Ⅱ.熔体化学键分析
熔体中最基本的离子是Si、O、碱或碱土金属离子。其中Si-O键键性为离子键与共价键的(约52%)混合键。且
Si-O键具有高键能、方向性和低配位等特点。而熔体中R-O键的键性以离子键为主。当R2O、RO引入硅酸盐熔体
中时,Si4+能把R-O键上的氧离子吸引到自己周围,使Si-O键的键强、键长、键角发生改变,最终使桥氧断裂。
如果O/Si比升高,[SiO4]之间连接方式发生如下转变:石英的架状→层状→链状→岛状(用聚合物描述)。
Ⅲ.熔体形成过程
以Na2O—SiO2熔体为例。
A:石英的分化
一切硅氧聚合物来源于Na2O和SiO2的相互作用,石英颗粒表面有断键,并与空气中水汽作用生成 Si-OH键,与
Na2O相遇时发生离子交换。
1处的化学键加强!2处的化学键减弱!
Na2O“进攻”弱点-石英骨架“分化”-形成聚合物。
(图见视频)
B:升温和无序化
以SiO2结构作为三维聚合物、二维聚合物及线性聚合物。在熔融过程中随时间延长,温度上升,
陆佩文《无机材料学基础》考点精讲及复习思路
5
熔体结构更加无序化。
线性链:围绕Si-O轴发生转动、弯曲。
二维聚合物:层发生褶皱、翘曲。
三维聚合物:(残余石英碎片)热缺陷数增多,同时Si-O-Si键角发生变化。
C:缩聚反应
各种低聚物相互作用形成高聚物:
[SiO4]Na4+[SiO4]Na4→[Si2O7]Na6+Na2O [SiO4]Na4+[Si2O7]Na6→[Si3O10]Na8+Na2O
D:熔体中的可逆平衡
熔体中有多种多样的聚合物,高温时低聚物各自以分立状态存在,温度降低时有一部分附着在三
维碎片上,形成“毛刺”结构。温度升高“毛刺”脱开。反应的实质是:2O-Ob+O
2-
(2)影响熔体结构的两大因素(组成和温度)
Ⅰ.当温度不变时,熔体组成的O/Si比(R)高,则表示碱性氧化物含量较高,分化作用增强,从而
Onb增多,低聚物也增多。
Ⅱ.当熔体组成不变时,随温度升高,低聚物数量增加;否则反之。
Ⅲ.小结
聚合物形成大致分为三个阶段:
初期:主要是石英颗粒的分化;
中期:缩聚反应并伴随聚合物的变形;
后期:在一定温度(高温)和一定时间(足够长)下达到聚合 解聚平衡。
(3)聚合物理论要点
A:硅酸盐熔体是由不同级次、不同大小、不同数量的聚合物组成的混合物。所谓的聚合物是指由
6
[SiO4]连接起来的硅酸盐聚离子。
B:聚合物的种类、大小、分布决定熔体结构,各种聚合物处于不断的物理运动和化学运动中,并在
一定条件下达到平衡。
C:聚合物的分布决定熔体结构,分布一定,结构一定。
D:聚合物的种类、大小、数量随温度和组成而发生变化。
考点四 熔体的性质-粘度
(1)粘度定义
使相距一定距离的两个平行平面以一定速度相对移动所需的力。单位为Pa·s。
(2)粘度的理论解释
Ⅰ.绝对速度理论
φ=φoexp(-
ΔE
kT)
η=ηoexp(
ΔE
kT)
φ=1/η
△E-质点移动的活化能,位垒
T升高→△E下降→η下降将粘度公式取对数:
lgη=A+B/T其中:A=lgη0;B=(△E/k)lge
有图显示:lgη~1/T并非直线关系;低温活化能是高温的2-3倍(多数);Tg—Tf温度范围活化能突变。
Ⅱ.自由体积理论
液体内分布着不规则,大小不等的空隙,液体流动必须打开这些“空 洞”,允许液体分子的运动,
这种空洞为液体分子流动提供了空间,这些空隙是由系统中自由体积Vf的再分布所形成的。
Vf=V-V0
V表示在温度T时液体分子表观体积,V0表示T0温度时液体分子紧密堆积的最小体积。
T↑→体积膨胀至V→形成Vf→为分子运动提供空隙→Vf越大→
易流动→η小。(晶体熔化成液体时一般体积增大10% )
Ⅲ.过剩熵理论
液体由许多结构单元构成,液体的流动就是这些结构单元的再排列过程。
陆佩文《无机材料学基础》考点精讲及复习思路
7
T↓构形熵So↓结构单元尺寸↑流动性↓混乱程度↓
(3)熔体粘度与组成的关系
Ⅰ.R+对R2O-SiO2熔体黏度的影响
R2O含量<25mol% ,O/Si比较低时,对粘度起主要作用的是四面体间Si-O的键力;再引入R2
O,其中Li+半径小,削弱Si-O键的作用大,所以 Li2O降粘度较 Na2O、K2O显著,此时相应熔体的粘
度。此时相应的熔体粘度:
ηLi2O<ηNa2O<ηK2O
当R2O含量>25mol%,O/Si比高时,此时[SiO4]之间连接已接近岛状,孤立[SiO4]很大程度上
依靠碱金属离子相连。再引入R2O,Li
+键力大使熔体粘度升高,所以 Li2O升高粘度较 Na2O、K2O显
著,此时相应的熔体粘度:
ηLi2O>ηNa2O>ηK2O
例题:当SiO2含量比较高时,碱金属氧化物降低熔体粘度的能力是A。
A.Li2O>Na2O>K2O B.K2O>Na2O>Li2O
C.Na2O>Li2O>K2O D.K2O>Li2O>Na2O
Ⅱ.R2+对粘度作用
R2+对O/Si影响与R+相同,同时应考虑离子极化对粘度的影响。Zn2+、Cd2+、Pb2+(含18e外
层)有很大的极化作用,因此比碱金属离子熔体有更低的粘度。R2+降粘度次序:
Pb2+>Ba2+>Cd2+>Zn2+>Ca2+(某些情况)>Mg2+
Ⅲ.三价离子的作用
A:B2O3对粘度的影响(硼反常)
[BO3]+Onb[BO4]
B:Al2O3补网作用时粘度增加。
8
Ⅳ.混合碱效应
熔体中引入一种以上的 R2O与 RO时,粘度比等量的一种 R2O或 RO高,这可能和离子半径、配
位数等结晶条件不同而相互制约有关。
例:η0.1MgO+0.2CaO>η0.3MgO>η0.3CaO
例题:解释图中现象?
答:从图可见,在16Na2O·84SiO2硅酸盐玻璃中,以B2O3逐渐取代SiO2,加入量较少时,B2O3吸收
Na2O提供的游离氧,由[BO3]三角体转变为[BO4]四面体,使玻璃结构网络紧密,粘度上升;当Na2O/
B2O3=1时,所有[BO3]全部转变为[BO4],玻璃粘度达极大值;B2O3含量继续增加,B2O3处于[BO3]
中,使玻璃结构网络变松,因而粘度下降。这就是“硼反常”现象。
考点五 熔体的性质-表面张力
(1)定义
扩展液体表面需要做功,表面能即将表面增大一个单位面积所需要作的功(或把质点从内部移到
表面所消耗的能量)。
单位:N/m或 J/m2
比较:数值相同,但表面张力是向量,表面能是标量。
(2)影响表面张力(σ)的因素
分析表面张力的变化一方面考虑单位表面的质点数,另一方面考虑表面质点受内部的结合力
Ⅰ.T升高→质点间距增大→质点间作用力减小→σ减小
Ⅱ.Na2O含量增加→解聚作用增强→聚合物尺寸减小→聚合物数量增多→σ增大。熔体σ由大
到小排列顺序为σLi2O>σNa2O>σK2O。
Ⅲ.B2O3的影响:[BO3]作平行于表面排列,层间结合力较小,表面张力很小(σ=80N/m),这样
的表面与熔体内部之间能量差较小,所以B2O3是瓷釉中常用的降低表面张力的组分。
Ⅳ.两种熔体混合时,表面张力不具加和性,其中较小的被排挤到表面富集,混合体的表面张力以
较小的为主。
陆佩文《无机材料学基础》考点精讲及复习思路
9
考点六 玻璃的通性
A:各向同性
均质玻璃其各方向的性质如折射率、硬度、弹性模量、热膨胀系数、导热系数等都相同(非均质玻
璃中存在应力除外)。
玻璃的各向同性是其内部质点无序排列而呈现统计均质 结构的外在表现。
B:介稳性
热力学-高能状态,有析晶的趋势。
动力学-高粘度,析晶不可能,长期保持介稳态。
冷却速率会影响Tg大小,快冷时Tg较慢冷时高,K点在F点前。
注意:Tg:玻璃形成温度,又称脆性温度。它是玻璃出现脆性的最高温度,由于在这个温度下可以
消除玻璃制品因不均匀冷却而产生的内应力,所以也称退火温度上限。
Tf:软化温度。它是玻璃开始出现液体状态典型性质的温度。是玻璃可拉成丝的最低温度。
C:凝固的渐变性和可逆性
由熔融态向玻璃态转变的过程是可逆的与渐变的,这与熔体的结晶过程有明显区别。
D:由熔融态向玻璃态转化时,物理、化学性质随温度变化的连续性。
考点七 玻璃的形成
(1)玻璃形成的热力学观点
10
ΔGv越大析晶动力越大,越不容易形成玻璃。
ΔGv越小析晶动力越小,越容易形成玻璃。
(2)形成玻璃的动力学手段
Ⅰ.Tamman观点
影响析晶因素:成核速率Iv和晶体生长速率u,需要适当的过冷度T=TM-T。
Iv=PD
其中:P-临界核坯的生长速率
D-相邻原子的跃迁速率
一方面:ΔT↑,质点动能↓,质点间引力↑,容易聚集,对成核有利。
一方面:ΔT↑,粘度↓,质点运动困难,难于扩散到晶核表面,不利于晶核长大。
U=Bexp(-ΔGa/kT)[1-Bexp(-ΔGv/kT)]
其中:①项-质点长程迁移的影响
②项-与ΔGv有关,晶体态和玻璃态两项自由能差.
总析晶速率:
过冷度太小或过大,对成核和生长均不利,只有在一定过冷度下才能有最大的 IV和 u。如果 IV和
u的极大值所处的温度范围很靠近,熔体就易析晶而不易形成玻璃。反之,就不易析晶而易形成玻璃。
陆佩文《无机材料学基础》考点精讲及复习思路
11
例题:熔体析晶遵循形核-长大机理,I、U曲线峰值大小及位置直接影响析晶过程及制品性质,
当I-U重叠面积大且过冷度大时,容易得到(C)。
A.不能析晶,得到玻璃 B.晶粒少、尺寸大的粗晶
C.晶粒多、尺寸小的细晶 D.晶粒多,尺寸大的粗晶
Ⅱ.Uhlmann观点
三T图中的三T即:
Time-Temperature-Transformation
确定玻璃中可以检测到的晶体的最小体积
(Vβ/V=10
-6)。
考虑熔体究竟需要多快的冷却速率才能防止此结晶量的产生,从而获得检测上合格的玻璃。
10-6=
Vβ
V≈(
π
3IVu
3t4)
三T曲线的绘制:
①选择一个特定的结晶分数10-6;
②在一系列温度下计算成核速率IV、生长速率u;
③把计算所得IV、u代入上式求出对应时间t;
④以 ΔΤ=ΤM-T为纵坐标,冷却时间t为横坐标作出3T图。
只有三T曲线前端即鼻尖对应析出10-6体积分数的晶体的时间是最少的。为避免析出10-6分
数的晶体所需的临界冷却速率可由下式近似求出。
(dT/dt)c≈ΔTn/τn (ΔTn=TM-Tn)
若(dT/dt)c大,则形成玻璃困难,反之则容易。
Ⅲ.熔点时的粘度高,易形成玻璃,析晶阻力较大,TM时的粘度是形成玻璃的主要标志。
(图见视频)
Ⅳ.Tg/TM接近“2/3”时,易形成玻璃,即三分之二规则。
12
(3)玻璃形成的结晶化学条件
Ⅰ.键强
A:单键强度>335kj/mol(或80kcal/mol)的氧化物-网络形成体(SiO2、B2O3)。
B:单键强度<250kj/mol(或60kcal/mol)的氧化物为网络变性体(大部分碱或碱土金属氧化物)。
C:在250~335kj/mol为中间体,作用介于玻璃形成体和网络形成体之间(Al2O3)。
Ⅱ.键型
A:离子化合物
如NaCl、CaCl2在熔融状态以正、负离子形式单独存在,流动性很大。由于离子键作用范围大,无
方向性且有较高的配位数,组成晶格的几率较高,在凝固点由库仑力迅速组成晶格,所以很难形成
玻璃。
B:金属键物质在熔融时失去联系较弱的 e后以正离子状态存在。价电子属于一定的能带,不固
定在某一个局部,由于金属键无方向性和饱和性,原子相遇组成晶格的几率最大(CN=12),很难形成
玻璃。
C:纯粹共价键物质大部分为分子结构,在分子内部以共价键相联系,而分子之间是无方向性的范
德华力,在冷却过程中形成分子晶格的几率比较大,很难形成玻璃。
结论:三种纯键型在一定条件下都不能形成玻璃。
D:离子共价混合键或金属共价混合键容易形成玻璃
a:当离子键向共价键过渡,离子共价混合键,主要在于有SP电子形成的杂化轨道,并构成σ键和
π键,强烈的极化作用,这种混合键既具有离子键易改变键角、易形成无对称变形的趋势,有利于造成
玻璃的远程无序,又有共价键的方向性和饱和性,不易改变键长和键角的倾向,造成玻璃的近程有序,
因此容易形成玻璃。
b:当金属键向共价键过渡称为金属共价键。在金属中加入半径小电荷高的半金属离子(Si4+、
P3+、B3+)或加入场强大的过渡金属原子产生强烈的极化作用,从而形成spd或spdf杂化轨道,形成金
属和加入元素形成的原子团,使得玻璃近程有序,但金属的无方向性和饱和性则使这些原子团之间可
以自由连接,形成无对称变形的趋势从而形成金属玻璃的远程无序。
陆佩文《无机材料学基础》考点精讲及复习思路
13
练习题:
1)在硅酸盐熔体中,当以低聚物为主时,体系的粘度低、析晶能力大。( )
2)物质在熔点时的粘度越 越容易形成玻璃,Tg/Tm 2/3(略大于,等于,略小于)
时容易形成玻璃。
考点八 玻璃的结构
玻璃的结构:是指玻璃中质点在空间的几何配置、有序程度以及彼此间的结合状态。
玻璃结构特点:近程有序,远程无序。
(1)晶子学说
27Na2O-73SiO2的x射线散射强度曲线
第一峰:是石英玻璃衍射的主峰与晶体石英特征峰一致。
第二峰:是Na2O-SiO2玻璃的衍射主峰与偏硅酸钠晶体的特征峰一致。
在钠硅玻璃中,上述两个峰均同时出现。
SiO2的含量增加,第一峰明显,第二峰减弱;
A:学说要点
玻璃由无数的“晶子”组成。所谓“晶子”不同于一般微晶,而是带有晶格变形的有序区域,它分
散于无定形的介质中,并且“晶子”到介质的过渡是逐渐完成的,两者之间无明显界线。
B:学说核心
结构的不均匀性及近程有序性。
C:意义及评价
第一次揭示了玻璃的微不均匀性,描述了玻璃结构近程有序的特点。
D:不足之处
晶子尺寸太小,无法用x-射线检测,晶子的含量、组成也无法得知。
(2)无规则网络学说
形成玻璃的物质与相应的晶体类似,形成相似的三维空间网络。网络由离子多面体(四面体或三
角体)构筑起来的。
晶体:结构网由多面体无数次有规律重复构成。
玻璃:结构多面体的重复没有规律性。
14
由于石英玻璃和方石英的特征谱线重合,瓦伦认为石英玻璃和方石英中原子间距大致一致。石
英玻璃中没有象硅胶(粒子间有间距和空隙)一样的小角度衍射,从而说明是一种密实体,结构中没有
不连续的离子或空隙。
A:学说要点
a:形成玻璃的物质与相应的晶体类似,形成相似的三维空间网络。
b:这种网络是由离子多面体通过桥氧相连,向三维空间无规律的发展而构筑起来的。
c:电荷高的网络形成离子位于多面体中心,半径大的变性离子,在网络空隙中统计分布。
d:氧化物要形成玻璃必须具备四个条件:
每个O最多与两个网络形成离子相连。
多面体中阳离子的配位数≤4。
多面体共点而不共棱或共面。
多面体至少有3个角与其它相邻多面体共用。
B:意义及评价
a:说明玻璃结构宏观上是均匀的。解释了结构上是远程无序的,揭示了玻璃各向同性等性质。
b:不足之处是对分相研究不利,不能完满解释玻璃的微观不均匀性和分相现象。
(3)两个学说比较
两种假说各具优缺点,两种观点正在逐步靠近。统一的看法是玻璃是具有近程有序、远程无序结
构特点的无定形物质。
晶子假说着重于玻璃结构的微不均匀和有序性。
无规则网络学说着重于玻璃结构的无序、连续、均匀和统计性。
它们各自能解释玻璃的一些性质变化规律。
考点九 硅酸盐玻璃
(1)玻璃的结构参数
A:计算
当R2O、RO等氧化物引入石英玻璃,形成二元、三元甚至多元硅酸盐玻璃时,由于 O/Si比增加,
三维骨架破坏,玻璃性能改变。
R=O/Si比,即玻璃中氧离子总数与网络形成离子总数之比。
X=每个多面体中平均非桥氧数(百分数)=X/(X+Y/2)。
Y=每个多面体中平均桥氧数(百分数)=Y/2/(X+Y/2)。
Z=每个多面体中氧离子平均总数(一般硅酸盐和磷酸盐玻璃中为4,硼酸盐玻璃中为3)。
参数间存在的关系:
X+Y=Z
X+Y/2=R
X=2R-Z{Y=2Z-2R
例1:10%molNa2O·8%molCaO·82%molSiO2
陆佩文《无机材料学基础》考点精讲及复习思路
15
Z=4 R=(10+8+82×2)/82=2.22
X=2R-Z=0.44 Y=3.56
例2:10%molNa2O·8%molAl2O3·82%molSiO2
Z=4 R=(10+24+82×2)/(82+8×2)=2.02
X=0.04 Y=3.96
注:有些离子不属典型的网络形成离子或网络变性离子,如Al3+、Pb2+等属于所谓的中间离子,这
时就不能准确地确定R值。
若(R2O+RO)/Al2O3>1,则有[AlO4],即为网络形成离子;
若(R2O+RO)/Al2O3<1,则有[AlO6],即为网络变性离子;
若(R2O+RO)/Al2O3!1,则有[AlO4],即为网络形成离子。
B:结构参数Y
玻璃的很多性质取决于Y值。Y<2时硅酸盐玻璃就不能构成三维网络。在形成玻璃范围内:
Y增大网络紧密,强度增大,粘度增大,膨胀系数降低,电导率下降。
Y下降网络结构疏松,网络变性离子的移动变得容易,粘度下降,膨胀系数增大,电导率增大。
例题:2Na2O·CaO·Al2O3·2SiO2的玻璃中,结构参数Y为 。
A.2.25 B.2.5 C.3 D.3.5
例题:有两种不同配比的玻璃,其组成如下:
序号 Na2Owt% Al2O3wt% SiO2wt%
1 10 20 70
2 20 10 70
试用玻璃结构参数说明两种玻璃高温下粘度的大小?
注意:①质量百分数要变成摩尔百分数。
②注意Al2O3的性质。
序号 Na2Omol% Al2O3mol% SiO2mol%
1 10.57 12.86 76.57
2 20.3 6.17 73.49
对于1:Na2O/Al2O3<1,所以Al2O3为网络变性体
Z=4
R1=(10.57+3×12.86+2×76.57)/76.57=2.64
∴Y1=2.72
对于2:Na2O/Al2O3>1,所以Al2O3为网络形成体
Z=4
16
R2=(20.3+3×6.17+2×73.49)/(2×6.17+73.49)=2.17
∴ Y2=3.66
∵ Y1"Y2∴ 序号1的玻璃组成的粘度比序号2的玻璃小。
(2)硅酸盐玻璃与硅酸盐晶体结构上显著的差别
A:晶体中Si-O骨架按一定对称性作周期重复排列,是严格有序的,在玻璃中则是无序排列的。
B:晶体中R+或R2+阳离子占据点阵的固定位置:在玻璃中,它们统计地分布在空腔内,平衡 Onb
的负电荷。
C:晶体中,只有半径相近的阳离子能发生互相置换,玻璃中,只要遵守静电价规则,不论离子半径
如何,网络变性离子均能互相置换。(因为网络结构容易变形,可以适应不同大小的离子互换)。
D:在晶体中一般组成是固定的,并且符合化学计量比例(除固溶体外),在形成玻璃的组成范围
内氧化物以非化学计量任意比例混合。
考点十 硼酸盐玻璃
B-O键能498kj/mol,比Si-O键能444kj/mol大,但因为B2O3玻璃的层状或链状结构的特性,任
何[BO3]附近空间并不完全被三角体所充填,而不同于[SiO4]。
B2O3玻璃的层之间是分子力,是一种弱键,所以B2O3玻璃软化温度低(450℃),表面张力小,化学
稳定性差(易在空气中潮解),热膨胀系数高。
一般说纯B2O3玻璃实用价值小。但B2O3是唯一能用来制造有效吸收慢中子的氧化物玻璃,而且
是其它材料不可取代的。
B2O3与R2O、RO等配合才能制成稳定的有实用价值的硼酸盐玻璃。当 B2O3中加入 R2O、RO时
会出现“硼反常”。
硼酸盐玻璃分相,可使玻璃发生乳浊。
例题:硅酸盐熔体中,O/Si减小时,下列变化分别是:
(1)碱性氧化物含量( )。
(2)非桥氧( )。
(3)熔体粘度( )。
(4)析晶倾向( )。
(5)聚合度( )。(a)不变,(b)降低,(c)增加。
例题:分析Na2O、Al2O3、B2O3、SiO2、CaO对硅酸盐熔体粘度的影响。
1)Na2O含量<25mol%,O/Si比较低时,对粘度起主要作用的是四面体间Si-O的键力;引入 R2
O,削弱Si-O键,粘度降低。
2)CaO对 O/Si影响与 R+相同,同时应考虑离子极化对粘度的影响。因此比碱金属离子熔体有
更低的粘度。
3)Al2O3视其含量不同可能起补网和破坏网络两种作用,补网时粘度增强。
陆佩文《无机材料学基础》考点精讲及复习思路
17
4)B2O3加入量少时,可以增大粘度,当加入量太多时,粘度反而减小。
5)SiO2会增大粘度。
例题:从熔体中析晶的过程分二步完成,首先是成核,然后就是晶体生长过程。均匀成核的成核
速率由受核化位垒影响的成核率因子和受原子扩散影响的成核率因子所决定的。
4.本章历年经典试题回顾
1.(江苏大学2012、3分)判断题:碱金属氧化物的加入会使氧化物玻璃的结构变得疏松。( )
2.(江苏大学2012、3分)名词解释:玻璃结构的晶子学说
3.(江苏大学2012、5分)试述玻璃形成的结晶化学条件。
4.(江西理工大学2011、8分)在钠硅酸盐玻璃中,分析 Na2O的含量对熔体黏度的影响,并说明
理由。
5.(江西理工大学2011、8分)两种玻璃其组成(mol%)如下表:试计算玻璃的结构参数,并比较良
好总玻璃的粘度在高温下何者大?
6.(10分2012年江西理工大学)在钠硅酸熔体中,分析 Na2O对熔体表面张力的影响,并说明理
由。为什么相同组成的固体表面能总是高于液体的表面能?
7.(2分2011年 山东建筑大学)SiO2、B2O3等氧化物能单独形成玻璃,称为网络形成体,而 K2O、
CaO等氧化物只能改变玻璃网络结构,称为网络变性体。
8.(2分2011年 山东建筑大学)熔体的析晶过程是由成核和晶体生长共同构成的,这两个过程
都需要适当的过冷度。
9.(10分2011年 山东建筑大学)一种纳钙硅酸盐玻璃的组成为14%Na2O·13%CaO·73%SiO2
(质量分数),试计算玻璃的结构参数值(X,Y,Z,R)。
10.(4分2011年山东建筑大学)试述玻璃的通性有哪些?
11.(2分2012年山东建筑大学)SiO2、B2O3等氧化物能单独形成玻璃,称为网络形成体,而 K2O、
CaO等氧化物只能改变玻璃网络结构,称为网络变性体。
12.(3分2012年山东建筑大学)一种玻璃的组成为14%Na2O·13%CaO·73%SiO2(质量分
数),则玻璃的结构参数值R=2.36,X=0.72,Y=3.28。
13.(6分2012年 山东建筑大学)玻璃网络形成体和玻璃网络变性体。
14.(4分2012年 山东建筑大学)玻璃的通性有哪些?
15.(15分2007年 山东轻工业学院)试用实验方法鉴别晶体SiO2、SiO2玻璃、硅胶和SiO2熔体,他
们的结构有何不同。
18
16.(3分2008年 山东轻工业学院)Tg为玻璃的形成温度,Tf为玻璃的软化温度。
17.(15分2008年 山东轻工业学院)有两种玻璃组成①SiO2②2Na2O·SiO2,计算X、Y、R值,说
明两种玻璃的膨胀系数大小以及化学稳定性的大小。
18.(15分 2008年 山东轻工业学院)简述温度、化学组成(SiO2、CaO、NaO)对硅酸盐熔体黏度的
影响。
19.(6分 2008年 山东轻工业学院)网络形成体:单键强度 >335kj/mol(或80kcal/mol)的氧化
物,能够单独形成玻璃,叫做网络形成体(SiO2、B2O3)。
20.(6分 2008年 山东轻工业学院)硼反常现象:硼酸盐玻璃与相同条件下的硅酸盐 玻璃相比,
其性质随R2O或RO加入量的变化规律想反,这种现象称硼反常现象。
21.(10分 2008年 山东轻工业学院)分析 Na2O、Al2O3、B2O3、SiO2、CaO对硅酸盐熔体粘度的
影响。
22.(10分 2008年 山东轻工业学院)试用图例说明过冷度对核化、晶化速率、析晶范围、析晶数量
和晶粒尺寸的影响。
23.(3分 2010年 山东轻工业学院)玻璃网络形成剂
24.(8分 2010年 山东轻工业学院)试比较硅酸盐玻璃与硅酸盐晶体结构上的异同。
25.(8分 2010年 山东轻工业学院)计算玻璃①Na2O·1/3Al2O3·2SiO2,②Na2O·2SiO2网络结
构参数?并比较其热稳定性、电导、粘度的大小。
26.(10分2006西北工业大学)陶瓷晶体相可分为哪两大类?有何共同特点?
27.(10分2007西北工业大学)固体中有哪些常见的相结构?
28.(1.5分2003武汉理工大学)玻璃转变温度 Tg
29.分2004年 武汉理工大学)临界冷却速率是形成玻璃所需要的最小冷却速率,临界冷却速率越
大越容易形成非晶体。( )
30.(10分2004年 武汉理工大学)根据玻璃的形成条件,对下列几种物质形成玻璃的难易程度进
行排序,并说明理由。Cu、SiO2、Na2O· SiO2、Na2O· 2SiO2、NaCl
31.(2006年 武汉理工大学)熔体结晶时,显示核化速率-温度、晶化速率-温度关系及对总结晶
速率的影响;核化速率与晶化速率的不同对新相的显微结构有何影响,为什么?指出在哪一温度范围
内对形成玻璃有利,为什么?
32.(2分 2007年 武汉理工大学)网络形成体
33.(2007年 武汉理工大学)在钠硅酸盐玻璃中,分析Na2O对熔体粘度的影响,并说明理由。
34.(2008年 武汉理工大学)分析熔体Na2O·2SiO2、Na2O·SiO2、2Na2O·SiO2的粘度以及表面张
力大小。并比较其形成玻璃的能力。
35.(2008年 武汉理工大学)从熔融态向玻璃态的转化取决于( )速率和( )。
36.(2009年 武汉理工大学)硅酸盐熔体中各种聚合程度的聚合物浓度受( )和( )的 影
陆佩文《无机材料学基础》考点精讲及复习思路
19
响,玻璃体由熔融态向玻璃态转化的过程是( )。在一定温度范围完成,无固定熔点。
37.(2010年 武汉理工大学 4分)玻璃网络形成体和玻璃网络外体
38.(2010年 武汉理工大学 15分)根据玻璃形成的条件,对 SiO2,K2O·SiO2、K2O·2SiO2三种物
质形成玻璃的难易程度、热膨胀系数、电导率和熔融温度的大小进行排序,并说明理由。
38.(1分2009年 西南石油大学)升温或降温速率越快,测得的聚合物玻璃化温度越高。( )
40.(1分2007年 四川大学)在一定条件下,晶态和非晶态可以互相转化。( )
41.(1分2003南京工业大学)CVD法制备的非晶态硅也具有玻璃的四个通性( )
42.(1分2003南京工业大学)硅酸盐熔体是由不同级次、不同大小、不同数量的聚合物组成的混
合物。玻璃转变温度为Tg,玻璃软化温度为Tf,对应粘度分别为 10
13dPa.s和108dPa.s。
43.(1分2004南京工业大学)对于有的材料来说,不管冷却速率多么快,都不可能形成玻璃。
( )
44.(1分2005南京工业大学)CVD法制备的非晶态硅也具有玻璃的四个通性( )
45.(3分2005南京工业大学)玻璃具有下列四个同性:各向同性、介稳性、凝固的渐变性和可逆
性、由熔融态向玻璃态转化时,物理、化学性质随温度变化的连续性。
46.(4分2005南京工业大学)晶体生长包括成核和晶体生长两个过程,成核过程是受P因子和D
因子影响的。
47.(3分2008南京工业大学)硅酸盐熔体的粘度随碱金属氧化物含量增加而迅速增大。( )
48.(3分2008南京工业大学)玻璃具有下列四个同性:各向同性、介稳性、凝固的渐变性和可逆
性、由熔融态向玻璃态转化时,物理、化学性质随温度变化的连续性。
49.(3分2008南京工业大学)熔体是a的混合物。
各种聚合度的聚合物和游离碱 b.不同聚合程度的各种聚合物
各种低聚物 d.各种高聚物
50.(3分2008南京工业大学)与玻璃形成温度Tg相对应的粘度为d。
108dPa.s b.1010dPa.s c.1011dPa.s d.1013dPa.s
51.(3分2008南京工业大学)试计算 Na2O·CaO·Al2O3·2SiO2玻璃的四个结构参数 Z、R、
X、Y。
52.(3分2008南京工业大学)玻璃在常温下能长期稳定存在,因而它是热力学稳定态( )
53.(2009年 南京工业大学)3T图中的临界冷却速度大,则意味着容易形成玻璃,而析晶困难。
54.(3分2009南京工业大学)与玻璃形成温度Tf相对应的粘度为a。
a.108dPa.s b.1010dPa.s c.1011dPa.s d.1013dPa.s
55.(3分2009南京工业大学)容易形成玻璃的物质往往具有 之类的键型。
a.离子键 b.金属键 c.极性共价键 d.共价键
56.(3分2009南京工业大学)熔体是物质在液相温度以存在的一种高能量状态,熔体在冷却过
20
程中可以出( )( )( )三种不同的相变过程。
57.(3分2009南京工业大学)网络形成体
单键强度 >335kj/mol(或80kcal/mol)的氧化物,能够单独形成玻璃,叫做网络形成体(SiO2、B2
O3)。
58.(4分 2012年 北京工业大学)玻璃具有下列通性:各向同性、介稳性、凝固的渐变性和可逆性、
由熔融态向玻璃态转化时,物理、化学性质随温度变化的连续性。
59.(3分2005浙江大学)非晶态固体的特点是:
A.具有短程有序而长程无序的结构
B.原子完全混乱无序地无规则排列
C.由许多小晶体取向无序形成的结构
60.(3分2005浙江大学)参与形成氧化物玻璃的氧化物常分为三种类型:分别是网络形成剂、网
络改变剂和中间剂,其主要为:
A.网络形成剂SiO2、B2O3、P2O5、V2O3、Sb2O3等;网络改变剂 Na2O、K2O、CaO、MgO、BaO等;中间
剂Al2O3、TiO2等。
B.网络形成剂SiO2、B2O3、P2O5、V2O3、MgO、BaO等;网络改变剂 Na2O、K2O、CaO、Al2O3、TiO2等;
中间剂As2O3、Sb2O3等。
C.网络形成剂Na2O、K2O、CaO、MgO、BaO等;网络改变剂 SiO2、B2O3、P2O5、V2O3、As2O3、Sb2O3
等;中间剂Al2O3、TiO2等。
61.(3分2005浙江大学)玻璃形成能力可以三T图(即温度-时间-转变)来判断。其中定义玻
璃中能测出的最小晶体体积与熔体之比约为:
A.10-5 B.10-6 C.10-7
62.(15分2005浙江大学)玻璃在高温下的粘度与该玻璃的桥氧有关,一般桥氧多,体系的高温
粘度就高。现有两不同组成的玻璃,(1)试计算两种玻璃的桥氧数,(2)判断两种玻璃高温粘度的
大小。
两种玻璃的配比如下:
样品 Na2Owt% Al2O3wt% SiO2wt%
G1 10 20 70
G2 20 10 70
注:由于是两性氧化物,当体系Al2O3超过Na2O的量时,Al
3+可视为网络改性离子,反之,则 Al3+
视为网络形成离子。
R=OSi=
12.6+13.8+73.6×2
73.6 =2.36
Z=4 X=2R-Z=2×2.36-4=0.72
陆佩文《无机材料学基础》考点精讲及复习思路
21
Y=Z-X=4-0.72=3.28
63.(10分2007年 浙江大学)氧化物玻璃形成稳定网络结构时满足:
64.(10分2007年 浙江大学)有两种不同配比的玻璃,其组成如下:
编号 Na2Omol% Al2O3mol% SiO2mol%
1 10.6 12.9 76.5
2 20.4 6.2 73.4
考虑到Al2O3中Al离子为两性离子,一般情况下当体系中Na2O的摩尔数比Al2O3的摩尔数小,则
Al离子表现为网络改性离子的特性,反之则具有网络形成离子的特性,(1)试计算这两种系统的桥氧
数(2)依据桥氧数判断在高温下这两个玻璃系统的粘度大小。
陕西科技大学
65.熔体析晶遵循形核-长大机理,I、U曲线峰值大小及位置直接影响析晶过程及制品性质,当 I
-U重叠面积大且过冷度大时,容易得到( )。
A.不能析晶,得到玻璃 B.晶粒少、尺寸大的粗晶
C.晶粒多、尺寸小的细晶 D.晶粒多,尺寸大的粗晶
66.在硅酸盐熔体中,当以低聚物为主时,体系的粘度低、析晶能力大。( )
67.物质在熔点时的粘度越 越容易形成玻璃,Tg/Tm 2/3(略大于,等于,略小
于)时容易形成玻璃。68.硅酸盐熔体中,O/Si减小时,下列变化分别是:
(1)碱性氧化物含量( )。
(2)非桥氧( )。
(3)熔体粘度( )。
(4)析晶倾向( )。
(5)聚合度( )。(a)不变,(b)降低,(c)增加。
69.分析Na2O、Al2O3、B2O3、SiO2、CaO对硅酸盐熔体粘度的影响。
70.从熔体中析晶的过程分二步完成,首先是成核,然后就是晶体生长过程。均匀成核的成核速
率由受核化位垒影响的成核率因子和受原子扩散影响的成核率因子所决定的。
71.2Na2O·CaO·Al2O3·2SiO2的玻璃中,结构参数Y为 。
A.2.25 B.2.5 C.3 D.3.5
72.在硅酸盐玻璃和硼酸盐玻璃中,随着 R2O的引入(<25mol%),玻璃熔体的粘度各发生怎样
变化?试用聚合物理论解释。
73.在硅酸盐熔体析晶的成核速率、生长速率随ΔT变化的关系图中,标出哪一条曲线代表成核速
率,哪一条曲线代表生长速率?为什么?
74.当SiO2含量比较高时,碱金属氧化物降低熔体粘度的能力是 。
22
A.Li2O>Na2O>K2O B.K2O>Na2O>Li2O
C.Na2O>Li2O>K2O D.K2O>Li2O>Na2O
5.本章小结
本章类型题大部分集中于问答题型(熔体与玻璃体组成、结构与性质之间的关系,熔体变成玻璃
体的热力学条件、动力学手段、结晶化学观点)、计算题(结构参数的计算)。但也可能出来一些名词解
释,如网络形成体、网络变性体、网络中间体、晶子学说、无规则网络学说等。
陆佩文《无机材料学基础》考点精讲及复习思路
23
第四章 晶体中的点缺陷和线缺陷
1.本章考情分析
本章主要介绍了晶体结构缺陷中一些最基本概念、分类及缺陷浓度的计算等知识,考试中主要在
名词解释、判断、简答以及计算题中有所涉及,相对来说属于基础题,没有较大题型,但切不可掉以轻
心,本章内容很可能与扩散一章内容综合起来出考题,所以要将这些基础知识掌握牢靠。本章内容与
生产实际结合的类型题并不多。
2.本章框架结构
本章首先介绍了缺陷的定义、分类、缺陷方程的书写,然后介绍缺陷浓度的计算方法、各种类型的
固溶体以及四种非化学计量化合物。
3.考点精讲
考点一 缺陷概述
(1)晶体结构缺陷定义
实际晶体与理想晶体相比有一定程度的偏离或不完美性,把两种结构发生偏离的区域叫缺陷。
(2)研究缺陷的意义
导电、半导体、发色(色心)、发光、扩散、烧结、固相反应。
考点二 点缺陷的基本类型
(1)根据对理想晶体偏离的几何位置分三类
A:空位-正常结点位置没有被质点占据,称为空位。
B:填隙原子-质点进入间隙位置成为填隙原子。
C:杂质原子-杂质原子进入晶格(结晶过程中混入或加入)。
间隙位置-间隙杂质原子;正常结点-取代(置换)杂质原子。
(2)根据产生缺陷的原因分三类
A:热缺陷-当晶体的温度高于绝对0K时,由于晶格内原子热运动,使一部分能量较大的原子离
开平衡位置造成的缺陷。
a:Frankel缺陷
形成:ZnZnZni +V″Zn
24
特点:空位和间隙成对产生;晶体密度不变。
b:Schotky缺陷
形成:正常格点的原子由于热运动跃迁到晶体表面,在晶体内正常格点留下空位。NaClV′Na
+VCl
特点:对于离子晶体,为保持电中性,正离子空位和负离子空位成对产生,晶体体积增大。
注意:Schotky缺陷形成的能量小于Frankel缺陷形成的能量,因此对于大多数晶体来说,Schotky
缺陷是主要的。
B:杂质缺陷
定义:杂质原子进入晶体而产生的缺陷。原子进入晶体的数量一般小于0.1%。
种类:间隙杂质和置换杂质。
特点:杂质缺陷的浓度与温度无关,只取决于溶解度和掺杂量。
C:非化学计量结构缺陷(电荷缺陷)
定义:存在于非化学计量化合物中的结构缺陷,化合物化学组成与周围环境气氛有关;不同种类
的离子或原子数之比不能用简单整数表示。
特点:非化学计量缺陷的实质为电荷缺陷。
练习题:晶体产生Frankel缺陷时,晶体体积 ,晶体密度 ;而有 Schotky缺陷时,
晶体体积 ,晶体密度 。一般说离子晶体中正、负离子半径相差不大时, 是
主要的;两种离子半径相差大时, 是主要的。
答案:不变,不变,变大,变小,Schotky缺陷,Frankel缺陷。
考点三 缺陷化学反应方程式及固溶式
满足三个条件:位置关系,电中性,质量平衡。
例1:CaCl2溶解在KCl中
CaCl2 →
KCl
CaK +V′K+2ClCl (1-1)
CaCl2 →
KCl
CaK +Cl′i+ClCl (1-2)
CaCl2 →
KCl
Cai +2V′K+2ClCl (1-3)
以上三种写法均符合缺陷反应规则。根据实际,(1-1)比较合理。
例2:MgO溶解到Al2O3晶格中
2MgO
Al2O
→
3
2Mg′Al+VO +2OO (1-4)
3MgO
Al2O
→
3
2Mg′Al+Mgi +3OO (1-5)
(1-5)较不合理。因为Mg2+进入间隙位置不易发生。
练习:MgCl2固溶在LiCl晶体中(产生正离子空位,生成置换型SS)
陆佩文《无机材料学基础》考点精讲及复习思路
25
MgCl2(S) →
LiCl
Mg.Li +V′Li+2ClCl
SrO固溶在Li2O晶体中(产生正离子空位,生成置换型SS)
SrO(S)
Li2
→
O
Sr.Li +V′Li+OO
Al2O3固溶在MgO晶体中(产生正离子空位,生成置换型SS)
Al2O3(S) →
MgO
2Al.Mg+V″Mg+3OO
YF3固溶在CaF2晶体中(产生正离子空位,生成置换型SS)
2YF3(S)
CaF
→
2
2Y.Ca +V″Ca+6FF
CaO固溶在ZrO2晶体中(产生负离子空位,生成置换型SS)
CaO(S)
ZrO
→
2
Ca″Zr+VO +OO
例题:试写出少量MgO掺杂到Al2O3中和少量YF3掺杂到CaF2中的缺陷方程。(a)判断方程的合
理性。(b)写出每一个方程对应的固溶式。
注意:因萤石晶体中存较多的八面体空隙,F-离子半径较小,形成填隙型固溶体比较稳定。在高
温下(>1800℃),因为ZrO2为萤石型结构,在高温下具有较大的立方体和八面体空隙,能够形成填隙
型缺陷。
例题:少量CaCl2在KCl中形成固溶体后,实测密度值随Ca
2+离子数/K+离子数比值增加而减少,
由此可判断其缺陷反应式为CaCl2 →
KCl
CaK +V′K+2ClCl。
例题:一块金黄色的人造刚玉,化学分析结果认为,是在 Al2O3中添加了 0.5mol%NiO和 0.
02mol%Cr2O3。试写出缺陷反应方程(置换型)及化学式。
解:缺陷反应式为
2NiO
Al2O
→
3
2Ni′Al+VO +2OO Cr2O3
Al2O
→
3
2CrAl+3OO
2 2 1 1 2
0.5% 0.5% 0.25% 0.02% 0.04%
固溶体的化学式为:
Al2-0.5%-0.04%Ni0.5%Cr0.04%O3-0.25%,即
Al1.9946Ni0.005Cr0.0004O2.9975
26
考点四 热缺陷和杂质缺陷浓度计算
热缺陷浓度:
n
N=exp(
-E
2KT)
E:缺陷形成能,1eV=1.602×10-19J
T:℃→K
K:1.38×10-23
杂质缺陷浓度:根据缺陷反应方程来计算。
例题:(a)在 CaF2晶体中,Frankel缺陷形成能为2.8eV,Schotky缺陷的生成能为5.5eV,计算在
25℃和1600℃时热缺陷的浓度?(b)如果 MgO晶体中,含有百万分之一的 Al2O3杂质,则在1600℃
时,MgO晶体中时热缺陷占优势还时杂质缺陷占优势?
解:(a)由题可知,Frankel缺陷形成能<Schotky缺陷的生成能,
由
n
N=exp(
-E
2KT)知,Frankel缺陷是主要的,为此:
在298K时,nN=exp(
-2.8×1.602×10-19
2×1.38×10-23×1873
)=1.70×10-4
在1873K时,nN=exp(
-2.8×1.602×10-19
2×1.38×10-23×298
)=2.06×10-24
(b)在MgO中加入百万分之一的Al2O3,缺陷方程如下:
Al2O3 →
MgO
2Al·Mg+V″Mg+3Oo
此时产生得缺陷为[V″Mg]杂质。
而[Al2O3]=[V″Mg]杂质 =10
-6,
由(a)计在1873K时,[V″Mg]热 =8×10
-9,
所以[V″Mg]杂质 >[V″Mg]热,在1873K时杂质缺陷占优势。
例题:对某晶体的缺陷测定生成能为84KJ/mol,计算该晶体在1000K和1500K时的缺陷浓度。
解:根据热缺陷浓度公式:
n
N=exp(-
ΔG
2kT)
由题意 △G=84KJ/mol=84000J/mol
则 nM=exp(-
ΔG
2RT)
其中R=8.314J/mol·K
当T1=1000K时,
n
M=exp(-
ΔG
2RT)=exp -
84000( )2×8.314×1000 =6.4×10
-3
当T2=1500K时,
n
M=exp(-
ΔG
2RT)=exp -
84000( )2×8.314×1500 =3.45×10
-2
例题:试写出在下列二种情况,生成什么缺陷?缺陷浓度是多少?(a)在 Al2O3中,添加 0.
陆佩文《无机材料学基础》考点精讲及复习思路
27
01mol%的Cr2O3,生成淡红宝石(b)在Al2O3中,添加0.5mol%的NiO,生成黄宝石。
解:(a)Cr2O3
Al2O
→
3
2CrAl+3OO
生成置换式杂质原子点缺陷。其缺陷浓度为:0.01%×2=0.0002
(b)2NiO
Al2O
→
3
2Ni′Al+VO +2OO
生成置换式的空位点缺陷。其缺陷浓度为:0.5%×3=0.015
考点五 非化学计量化合物
定义:把原子或离子的比例不成简单整数比或固定的比例关系的化合物称为非化学计量化合物。
实质:同一种元素的高价态与低价态离子之间的置换型固溶体。
非化学计量化合物可分为四种类型:
①阴离子间隙型②阳离子填隙型
③阳离子空位型④阴离子缺位型
(1)阴离子缺位型-TiO2-x
TiO2晶体在缺O2条件下,在晶体中会出现氧空位。缺氧的 TiO2可以看作 Ti
4+和 Ti3+氧化物的
SS,缺陷反应为:
2TiTi+4O →O 2Ti′Ti+VO +3OO+
1
2O2↑
色心定义:Ti4++e→ Ti3+,电子e并不固定在一个特定的Ti4+上,可把 e看作 在负离子空位周
围。因为VO 是带正电的,在电场作用下e可以迁移,形成电子导电,易形成色心。(NaCl在Na蒸汽
下加热呈黄色)
氧分压与空位浓度关系:K=
[VO ][PO2]
1
2[e′]2
[OO]
平衡常数:[Oo]≈1,又2[Vo ][e′]
2
假定:OOVO +12O2↑+2e′ K=4[V
0 ]
3[Po2]
1
2∴[Vo ]∝[PO2]
-16
例题:非化学计量化合物TiOx中,Ti
3+/Ti4+=0.1,求TiOx中的x值。
TiOx缺陷方程为:2TiTi+4O →O 2Ti′Ti+VO +3OO+
1
2O2↑
故固溶式可写成 Ti4+1-yTi
3+
y O2-y/2
28
由Ti3+/Ti4+=0.1知道y/(1-y)=0.1,解得y=0.091
于是TiOx中的x值为:x=2-y/2=2-0.091/2=1.95
(2)阳离子填隙型-Zn1+xO
ZnOZni +e′+
1
2O2↑
K=
[Zni][e
′][PO2]
1
2
[ZnO] ,∵[Zni]≈[e
′],[ZnO]≈1,K=[Zn]2[PO2]
1
2,
故[Zni]∝[PO2]
-14
(3)阴离子间隙
UU+2OO→UU +O″i+OO
即
1
2O2→O
″
i+2h由化学平衡得[O
″
i]∝[PO2]
1
6
(4)阳离子空位型-如Fe1-xO,Cu2-xO
为了保持电中性在正离子空位周围捕获电子空穴,是P型半导体。缺陷反应为:2FeFe+
1
2O2(g)
2FeFe+V
″
Fe+OO
2FeFe为Fe
3+取代Fe2+可写成2FeFe=2FeFe+2h即得
1
2O2(g)2h
+V″Fe+OO
注意:非化学计量化合物组成与缺陷浓度有关,并与氧分压有关,或与气氛有关。
V色心:为保持电中性,两个h·被吸引到 形成V-色心。电子空穴的与氧分压的1/6方成正比,
随着氧分压的增大,电导率相应增加。
例题:非化学计量化合物FexO中,Fe
3+/Fe2+=0.1,求FexO中空位浓度及x值。
分析:FexO是Fe2O3溶解在FeO中的非化学计量化合物,先写出缺陷方程式,然后根据Fe
3+/Fe2+
=0.1计算。
缺陷反应式:
Fe2O3 →
FeO
2FeFe+V″Fe+3OO
1 2 1
a 2a a
陆佩文《无机材料学基础》考点精讲及复习思路
29
其化学式为:Fe1-2a-aFe2aO
2a/1-3a=0.1 a=0.044
[V″Fe]=
a
1+X=2.25×10
-2
X=1-a=0.956
注:1+X为正常结点数
例题:
1)非化学计量化台物Cdl-xO由于在化学组成上偏离化学计量而产生的晶格缺陷是:(b)
a.阴离子空位 b.阳离子空位
c.阴离子填隙 d.阳离子填隙
考点六 固溶体
(1)固溶体的定义及应用
定义:含有外来杂质原子的晶体
几个概念区别:固溶体、化合物、混合物。
应用举例:
Al2O3晶体中溶入0.5~2Wt%的Cr
3+后,由刚玉转变为有激光性能的红宝石。
PbTiO3和PbZrO3固溶生成锆钛酸铅压电陶瓷,广泛应用于电子、无损检测、医疗等技术领域。
Si3N4和Al2O3之间形成sialon固溶体应用于高温结构材料等。沙隆陶瓷性质特点:高温强度大,
低温强度小。
(2)固溶体的分类
①按溶质原子在溶剂晶格中的位置划分:
间隙型固溶体;置换型固溶体
②按溶质原子在溶剂晶体中的溶解度分类:
连续型固溶体;有限型固溶体
(3)影响固溶体溶解度的因素
①离子大小
相互取代的离子尺寸越接近,就越容易形成固溶体;原子半径相差越大,溶解度越小。
若以r1和r2分别代表半径大和半径小的溶剂或溶质离子半径,则:
r1-r2
r1
<15% 形成连续固溶体
15%~30% 形成有限固溶体
>30%
{
不能形成固溶体
②晶体的结构类型
形成连续固溶体,两个组分应具有相同的晶体结构或化学式类似。MgO和 NiO、Al2O3和 Cr2O3、
30
Mg2SiO4和Fe2SiO4、PbZrO3和PbTiO3Fe2O3和Al2O3(0.0645nm和0.0535nm),比值:
0.0645-0.0535
0.0645 =17.05%
虽然结构同为刚玉型,但它们只能形成有限固溶体。
③离子电价-离子价相同或离子价态和相同
钠长石Na[AlSi3O8]-钙长石Ca[Al2Si2O8],离子电价总和为+5价:Na
++Si4+Ca2++Al3+
复合钙钛矿型压电陶瓷材料(ABO3型)
Pb(Fe3+1
2
Nb5+1
2
)O3→PbZrO3
(Na+1
2
Bi3+1
2
)TiO3→PbTiO3
④电负性
电负性相近-有利于SS的形成,电负性差别大-趋向生成化合物。
Darken认为电负性差Δ<±0.4,一般具有很大的固溶度,是固溶溶解度大小的一条边界。
例题:对于MgO、Al2O3和Cr2O3,其正、负离子半径比分别为0.47、0.36和0.40。Al2O3和Cr2O3形
成连续固溶体。(a)这个结果可能吗?为什么?(b)试预计,在 MgO-Cr2O3系统中的固溶度是有限
还是很大?为什么?
解:(a)Al2O3与Cr2O3有可能形成连续固溶体。因为:
①
R1-R2
R1
=0.40-0.360.40 =10%<15%
②结构类型相同,均属刚玉型结构。
(b)对于MgO-Cr2O3系统,由于结构类型相差较大,前者为NaCl型,后者为刚玉型。虽然
R1-R2
R1
=0.47-0.40.47 =14.89%<15%,也不可能形成完全互溶的固溶体,而只能是有限固溶。
(4)置换型固溶体
定义:当发生不等价的置换时,必然产生组分缺陷,即产生空位或进入空隙。
影响缺陷浓度因素:取决于掺杂量(溶质数量)和固溶度。其固溶度仅百分之几。
①产生阳离子空位
用焰熔法制备镁铝尖晶石得不到纯尖晶石,而生成“富 Al尖晶石”。原因:尖晶石与 Al2O3形成
SS时存在2Al3+置换3Mg2+的不等价置换。缺陷反应式为:Al2O3
MgAlO
→
4
2AlMg+V
″
Mg+3OO
②出现阴离子空位。
如CaO加入到ZrO2中,缺陷反应式为:
CaO
ZrO
→
2
Ca″Zr+VO +OO
加入CaO的原因:由于在1200℃时ZrO2有单斜→四方的晶型转变,伴有很大的体积膨胀,而不适
用于耐高温材料。若添加CaO使它和ZrO2形成立方CaF2型SS,则无晶型转变,成为一种极有价值的
陆佩文《无机材料学基础》考点精讲及复习思路
31
高温材料,叫稳定化氧化锆。
(5)间隙型固溶体
定义:若杂质原子较小,能进入晶格间隙位置内。
影响因素①:溶质原子的大小和溶剂晶体空隙大小
例:MgO只有四面体空隙,
TiO2结构中还有1/2“八孔”可以利用。
CaF2中有1/2“立方体空隙”可以被利用。
沸石,由硅、铝氧四面体组成的架比长石敞开得多,有很多大小均一的空洞和孔道为阳离子和水
分子所占据,结合很松,阳离子也容易发生可逆的离子交换。
则晶体形成间隙固溶体的次序必然是:
片沸石>CaF2>TiO2>MgO
例题:在下列几类晶体甲,形成间隙型固溶体的次序是(a)
a.沸石>CaF2>TiO2>MgO
b.MgO>TiO2>CaF2>沸石
c.CaF2>TiO2>MgO>沸石
d.TiO2>MgO>CaF2>沸石
影响因素②:保持结构中的电中性:
例:硅酸盐结构中嵌入Be2+、Li+等离子时,正电荷的增加往往被结构中Al3+代替Si4+而平衡。
常见间隙型固溶体实例:Be2++2Al3+2Si4+
a.原子填隙:例如C在Fe中间隙SS。过渡元素与C、B、N、Si等形成的硫化物、硼化物、氮化物、
硅化物等本质是SS。在金属结构中,C、B、N、Si占据“四孔”和“八孔”,称金属硬质材料,它们有高硬
或超硬性能,熔点极高。
b.离子填隙:2CaO
ZrO
→
2
Cai +Ca″Zr+2OO
阳离子填隙:YF3
CaF
→
2
YCa+F
′
i+2FF
阴离子填隙:2ZrO2
Y2O
→
3
2ZrY +O″i+3OO
(6)固溶体的研究方法
例题:CaO加到ZrO2中,在1600℃该固溶体为立方萤石结构。经x射线分析测定,当溶入0.15分
子CaO时晶胞参数a=0.513nm,实验测定的密度值D=5.477g/cm3。
解:从满足电中性要求考虑,可以写出两种固溶方式:
2CaO(s)
ZrO
→
2
Ca″Zr+Cai +2OO(1)
CaO(s)
ZrO
→
2
Ca″Zr+VO +OO(2)
32
如何确定其固溶方式?
由(1)式知固溶体的化学式:Zr0.925Ca0.15O2
密度的计算式:d=Z·M
a3·N0
d计算1=
4×(0.925×91.22+0.15×40.08+2×16)
(0.513×10-7)3×6.02×1023
=6.019g/cm3
由(2)式知其固溶体的化学式:Zr0.85Ca0.15O1.85
d计算2=
4×(0.85×91.22+0.15×40.08+1.85×16)
(0.513×10-7)3×6.02×1023
=5.564g/cm3
实测D=5.477g/cm3,接近d计算2,说明方程(2)合理。
例题:用0.2molYF3加入CaF2中形成固溶体,实验测得固溶体的晶胞参数 a=0.55nm,测得固溶
体密度ρ=3.64g/cm3,试计算说明固溶体的类型?(元素的相对原子质量:Y=88.90;Ca=40.08;F=
19.00)
解:YF3加入CaF2的缺陷反应方程如下:
(1)YF3
CaF
→
2
YCa+F′i+2FF
(2)2YF3
CaF
→
2
2YCa+V″Ca+6FF
方程(1)和(2)的固溶式:(1)Ca1-xYxF2+x (2)Ca(1-3/2x)YxF2
按题意x=0.2代入上述固溶式得:(1)Ca0.8Y0.2F2..2(2)Ca0.7Y0.2F2;它们的密度分别设为 ρ1和
ρ2。CaF2是萤石型晶体,单位晶胞内含有4个萤石分子。
ρ1=
4×0.8×40.08+4×0.2×88.9+8×2.2/2×19
6.02×1023×(0.55×10-7)3
=3.659(g/cm3)
ρ2=
4×0.7×40.08+4×0.2×88.9+8×2/2×19
6.02×1023×(0.55×10-7)3
=3.346(g/cm3)
由ρ1与ρ2计算值与实测密度ρ=3.64g/cm
3比较,ρ1值接近3.64g/cm
3,因此0.2molYF3加入CaF2
中形成间隙型固溶体。
四川大学练习题
1.MgO晶体在25℃时热缺陷浓度为1.92×10-51。
(肖特基缺陷生成能为6eV,1eV=1.6×10-19J,k=1.38×10-23J/K)
2.YF3加入到CaF2中形成固溶体,其缺陷反应式为 。
3.请说明非化学计量化合物与无限固溶体的异同;TiO2-x和 Fe1-xO分别为具有阴离子空位和阳
离子空位的非化学计量化合物。试说明其导电率和密度随氧分压PO2变化的规律。(以缺陷方程帮助
说明)
答:非化学计量化合物与无限固溶体的共同点:(1)都属于晶体结构缺陷中的点缺陷;(2)相组成
均为均匀单相。不同之处在于:(1)形成原因不同。非化学计量化合物由气氛性质和压力变化引起,
陆佩文《无机材料学基础》考点精讲及复习思路
33
而无限固溶体则由掺杂溶解而引起。(2)形成条件不同。前者只有变价元素氧化物在氧化或还原气
氛中才能形成,而后者则需满足离子半径和电负性差值较小、保持电中性、结构相同等条件才能形成。
(3)组成范围不同。前者的组成变化范围很小,而后者可以在整个组成范围内变化。
2)TiO2-x的缺陷反应方程为:
2TiTi+4O →O 2Ti′Ti+VO +3OO+
1
2O2↑
简化为:OOVO +12O2↑+2e′
平衡常数K=
[VO ][PO2]
1
2[e′]2
[OO]
假定[OO]≈1,又2[VO ]=[e′]
K=14
1
3
[PO2]
1
2
∴[VO ]∝[PO2]
-16or[e′]∝[PO2]
-16
根据质量守恒定律可得,故其密度随氧分压增加而增加,而电导率随氧分压的增加而减小,与氧
分压的1/6次方成反比。
Fe1-xO缺陷反应方程式为:
2FeFe+
1
2O2(g)2Fe
Fe+V″Fe+OO
1
2O2(g)2h
+V″Fe+OO
K=
[Oo][V″Fe][h]
2
P1/2O
[h]=2[V″Fe],[V″Fe]∝P
1/6
O2or[h]∝P
1/6
O2
根据质量守恒定律可得,故其密度随氧分压增加而下降,而电导率随氧分压的增加而增加,与氧
分压的1/6次方成正比。
4.本章历年经典试题回顾
2007武汉理工大学考研题
1)CsCl溶入MgCl2中形成空位型固溶体,写出固溶体的化学式。
2)Al2O3掺入到MgO中,请写出两个合理的方程及其固溶体化学式。
2008武汉理工大学考研题
1)形成弗伦克尔缺陷时,其特征是 和 成对出现。
2)将CaO掺入到ZrO2中,请写出两个可能的缺陷反应方程式,并写出对应的固溶体化学式。
2012江苏大学考研题
1)若两种物质形成连续固溶体,则这两种物质的电负性一定相同。(×)
34
2)在同一温度下,同一种物质的肖特基缺陷浓度一般远高于其弗兰克尔缺陷的浓度。(√)
3)名词解释:弗兰克尔缺陷
2011江西理工大学
1)名词解释:杂质缺陷
2012江西理工大学
1)名词解释:固溶体
2)问答题:在还原气氛中烧结含有 TiO2的陶瓷时,会得到灰黑色的 TiO2-x;写出产生 TiO2-x的反
应式;随还原气氛分压的变化,该陶瓷材料的电导率和密度如何变化?从化学的观点解释该陶瓷材料
为什么是一种n型半导体。
2011山东建筑大学
1)名词解释
肖特基缺陷 固溶体
2)填空
在点缺陷中,根据其对理想晶格偏离的几何位置及成分划分,可以分为空位、填隙原子和杂质
原子。
在非化学计量化合物TiO2-x中存在的晶格缺陷是阴离子空位型。
3)简答题
CaO加到ZrO2中时可能形成置换型固溶体(阴离子空位)和间隙型固溶体(阳离子间隙),试分别
写出形成两种固溶体时的缺陷反应方程。
2007山东轻工业学院
1)名词解释:
弗兰克尔缺陷
2)问答题
什么是固溶体和非化学计量化合物?研究固溶体有何意义?举例说明。
少量Al2O3加入到MgO中形成阳离子空位,写出其缺陷方程。
2008山东轻工业学院
1)名词解释:
弗兰克尔缺陷
2)填空题
热缺陷浓度与温度有关,非化学计量化合物缺陷浓度与氧分压有关。
3)问答题:
什么是非化学计量化合物,研究非化学计量化合物有何意义?举例说明。
陆佩文《无机材料学基础》考点精讲及复习思路
35
2009山东轻工业学院
1)非化学量化物的缺陷浓度与何因素有关,举例说明。
2)少量Al2O3加入到MgO中形成阳离子空位固溶体,写出缺陷方程。
2010山东轻工业学院
1)名词解释:
费仑克尔缺陷
非化学计量化合物
2)简答题
为了提高 ZrO2材料的热稳定性,材料中加入少量的CaO作为稳定剂。若加入 0.2mol的CaO,请
写出可能的缺陷反应程式、固溶分子式。
试述固溶体在无机固体材料制备中的意义。
2010武汉理工大学
1)问答题
问:正离子不等价置换可能形成的缺陷有哪些?
答:(1)高价正离子占据低价正离子位置时,该位置带有正电荷,为了保持电中性会产生间隙负离
子或正离子空位。
(2)低价正离子占据高价正离子位置时,该位置该有负电荷,为了保持电中性。会产生负离子空
位或者间隙正离子。
2)写出缺陷反应及固溶式。
CsCl
MgCl
→
2
C′sMg+Clcl+Vcl
x x x
CsxMg′′1-xCl2-x
Al2O3 →
MgO
2Al'Mg+2Oo+O″i Al2xMg1-2xO1+x
x 2x x
Al2O3 →
MgO
2Al'Mg+3Oo+V
'
Mg Al2xMg1-3xO(可能)
x 2x x
2011常州大学
1)少量CaC12在KCl中形成固溶体,试写出可能的缺陷反应方程式及相应的固溶分子式(写出二
种)。若实测此固溶体的密度随Ca2+离子数/K+离子数比值增加而减少,试判断哪一种缺陷反应更可
能发生?说明理由。(10分)
5.本章小结
本章类型题包括名词解释(点缺陷、热缺陷、非化学计量化合物、固溶体)、简答题(缺陷反应方程
36
的书写,影响固溶体溶解度的因素,固溶体具体应用举例)、计算题(热缺陷浓度计算、杂质缺陷浓度计
算、非化学计量化合物浓度计算及固溶体理论密度的计算)。
点缺陷的名称:填隙原子,空位,杂质原子
点缺陷的分类:热缺陷,杂质缺陷,非化学计量结构缺陷
热缺陷(温度高于0K,吸收能量发生热振动)
弗伦克尔缺陷:如果离开平衡位置的原子进入晶格的间隙位置,成为填隙原子。
空位和间隙原子同时出现,晶体体积不变,密度也不变。
肖特基缺陷:如果离开平衡位置的原子迁移至晶体表面的正常格点位置上,而晶体内仅有空位,
没有等量的间隙原子。仅有空位存在,晶体体积膨胀,密度下降,正离子空位与负离子空位同时存在。
杂质缺陷:由外来原子进入原有晶体点阵而产生的结构为杂质缺陷。与温度无关,只取决于溶
解度。
非化学计量结构缺陷(电荷缺陷)
固溶体:在固态条件下,一种组分内“溶解”了其它组分而形成的单一、均匀的晶态固体。
(填隙型,置换型)取代离子的尺寸越相近,越容易形成固溶体,半径相差越大,溶解度越小 。
固溶体的研究方法:
用x射线结构分析测定晶胞参数,并测试SS的密度和光学性能来判别SS的类型。
非化学计量化合物:把原子或离子的比例不成简单整数比或固定的比例关系的化合物称为非化
学计量化合物。
非化学计量化合物的类型
1.金属离子过剩,形成阴离子缺位———材料是n型半导体。
2.金属离子过剩,形成阳离子填隙———材料是n型半导体。
3.阴离子过剩,形成阴离子填隙如:UO2→UO2+x
(氧化气氛)由于结构中引入电子空穴,这种材料是p型半导体。
4.阴离子过剩,形成阳离子空位如:FeO·Fe1-xO
(氧化气氛)由于结构中引入电子空穴,这种材料是p型半导体。
陆佩文《无机材料学基础》考点精讲及复习思路
37
第六章 相平衡与相图
1.本章考情分析
本章系统阐述相图的基本原理。结合实际介绍相图在无机非金属材料的研究和生产实践中的具
体应用,考试题型主要涉及基础或专业二元及三元相图的分析,偶尔也有少量的填空、选择、判断、名
词解释以及计算题,相图的分析几乎是每个学校必考的内容,切不可掉以轻心。和其他章节内容相
比,本章内容中的单元系统相图、二元系统相图和三元系统相图的知识是环环相扣的,为此,要理解本
章内容,并不能单纯记忆某个知识点,而是将整章内容串联起来。
2.本章基本内容
本章首先介绍了凝聚态系统相平衡特点,然后分别介绍了单元系统相图、二元系统相图及三元系
统相图的基本理论及实际应用。
3.本章要点精讲
考点一 热力学平衡态和非平衡态
(1)平衡态
相图即平衡相图,反应的是体系所处的热力学平衡状态,即仅指出在一定条件下体系所处的平衡
态(其中所包含的相数,各相的状态、数量和组成)。与达平衡所需的时间无关。
硅酸盐熔体即使处于高温熔融状态,其粘度也很大,其扩散能力很有限,因而硅酸盐体系的高温
物理化学过程要达到一定条件下的热力学平衡状态,所需的时间是比较长的,所以实际选用的是一种
近似状态。
(2)介稳态
热力学非平衡态,经常出现于硅酸盐系统中。
注意:介稳态的出现不一定都是不利的。由于某些介稳态具有所需要的性质,因而创造条件(快
38
速冷却或掺加杂质)有意把它保存下来。如:水泥中的β-C2S,陶瓷中介稳的四方氧化锆,耐火材料
硅砖中的鳞石英以及所有的玻璃材料。
(3)材料系统中的相律
不含气相或气相可以忽略的系统称为凝聚系统。在温度和压力这二个影响系统平衡的外界因素
中,压力对不包含气相的固液相之间的平衡影响不大,变化不大的压力实际上不影响凝聚系统的平衡
状态。大多数材料(硅酸盐物质)属难熔化合物,挥发性很小,因而材料系统一般均属于凝聚系统,由
于对凝聚系统而言,压力这一平衡因素可以忽略,因而相律在凝聚系统中具有如下形式:
f=c-p+1
f-度数,c-组分数,p-相数,1-温度
A.相:指系统中具有相同的物理性质 和化学性质的均匀部分。(注:均匀微观尺度上的均匀,而
非一般意义上的均匀。)
(i)相与相之间有界面,可以用物理或机械办法分开。
(i)一个相可以是均匀的,但不一定是一种物质。
气体:一般是一个相,如空气组分复杂。
固体:有几种物质就有几个相,但如果是固溶体时为一个相。因为在 固溶体晶格上各组分的化学
质点随机分布均匀,其物理性质和化学性质符合相均匀性的要求,因而几个组分形成的固溶体是一个
相。
液体:视其混溶程度而定。
B.组分:组成系统的物质。
独立组分:足以表示形成平衡系统中各相所需要的最少数目的组分.
c=组分数-独立化学反应数目-限制条件
例如:CaCO3 →
Δ
CaO+CO2↑
C.自由度 (f)
定义:温度、压力、组分浓度等可能影响系统平衡状态的变量中,可以在一定范围内改变而不会
引起旧相消失新相产生的独立变量的数目。
考点二 相平衡研究方法
(1)热分析法
陆佩文《无机材料学基础》考点精讲及复习思路
39
原理:根据系统在冷却过程中温度随时间的变化情况来判断系统中是否发生了相变化。
优点:简便,不象淬冷法那样费时费力。
缺点:由于本质上是一种动态法,不象淬冷法那样更符合相平衡的热力学要求,所测得相变温度
仅是一个近似值只能测定相变温度,不能确定相变前后的物相,要确定物相仍需其它方法配合。
例题:绘出在低共熔点以上有多晶转变的二元系统的不同组成试样的冷却曲线,并在冷却曲线的
不同阶段标明系统中所存在的平衡相。
(2)差热分析法
例题:为了避免差热曲线的基线出现较大的漂移,有人采取的措施是将试样和标准样等重称量;
有人按照试样和标准样比热大小,采取等热容称量。哪一种措施正确,为什么?
答:应采取等热容原则。因为这样才能保证在相同加热速度下,被测试样和标准样的升温速度相
等,从而避免基线漂移。
(3)淬冷法
最大优点:准确度高。因为长时间保温较接近平衡状态,淬冷后在室温下又可对试样中平衡共存
的相数、各相的组成、形态和数量直接进行测定。
适用对象:适用于相变速度慢的系统,如果快则在淬冷时发生相变。
40
考点三 单元系统相图
(1)水的相图
解释界线的斜率:
由克劳修斯-克拉珀龙方程dP/dT=ΔH/TΔV,
从低温型向高温转变:ΔH>0,L g;S gΔV>0,则斜率>0;
而S L 冰变成水ΔV<0,斜率<0;
其它金属或SiO2,ΔV>0,则斜率>0。
对于有晶型转变的,由于ΔV很小,因而其界线几乎是垂直的。
(2)一元相图的型式
(3)可逆和不可逆的多晶转变
陆佩文《无机材料学基础》考点精讲及复习思路
41
实线表示稳定态,虚线表示介稳态。
晶体1晶体2液相
特点:(Ⅰ)晶体I,晶体2都有稳定区;
(Ⅱ)T12<T1,T2(熔点)
稳定相与介稳相的区别:
(Ⅰ)每一个稳定相有一个稳定存在的温度范围,超过这个范围就变成介稳相。
(Ⅱ)在一定温度下,稳定相具有最小蒸汽压。
(Ⅲ)介稳相有向稳定相转变的趋势,但从动力学角度讲,转变速度很慢,能长期保持自己的
状态。
晶体2→晶体→1液相
特点:
(Ⅰ)晶体I没有自己稳定存在的区域。
(Ⅱ)T12点是晶型转变点,T2是晶体I的熔点,T1是晶I的熔点。
考点四 SiO2系统的相图
位移性转变:不打开任何键,也不改变原子最邻近的配位数,仅仅使结构发生畸变,原子从原来位
置发生少许位移,使次级配位有所改变的一种多晶转变形式。
42
重建性转变:破坏原有原子间化学键,改变原子最邻近配位数,使晶体结构完全改变原样的一种
多晶转变形式。
(1)相图分析
(2)相图的应用
以耐火材料硅砖的生产和使用为例。
原料:天然石英(β-石英)
生产方式:高温煅烧
晶型转变:很复杂(原因:介稳状态的出现)
要求:鳞石英含量越多越好,而方石英越少越好。
实际情况:加热至573℃很快转变为α-石英,当加热至870℃不转变为鳞石英,在生产条件下,
常过热到1200℃~1350℃直接转变为介稳的α-方石英。
石英、鳞石英和方石英三种变体的高低温型转变中,方石英ΔV变化最大,石英次之,而鳞石英最
小。如果制品中方石英含量大,则在冷却到低温时,由于α-方石英转变成β-方石英有较大的体积
收缩而难以获得致密的硅砖制品。
采取的措施:
A:在870℃适当保温,促使鳞石英生成;
B:在1200-1350℃小心加快升温速度避免生成α-方石英;
C:在配方中适当加入 Fe2O3、MnO2、CaO或 Ca(OH)2等矿化剂,在1000℃左右产生一定量的液
相,α-石英、α-方石英在此液相中的溶解度大,而α-鳞石英的溶解度小,因而 α-石英、α-方石
英不断溶入液相,而α-鳞石英则不断从液相中析出。
练习题:1)何谓一级变体间和二级变体间的转变?对SiO2相变请举例说明。
2)硅砖生产中采取什么措施能获得多量磷石英,为什么?
3)在SiO2系统中,请说明耐火材料硅砖制品中为何希望鳞石英含量越多越好?方石英含量越少
越好?实际生产中可采取什么措施?
考点五 ZrO2系统
ZrO2有三种晶型:单斜ZrO2,四方ZrO2和立方ZrO2
陆佩文《无机材料学基础》考点精讲及复习思路
43
用途:a:作为特种陶瓷的重要原料。于 7% ~9%的体积效应,常加适量 CaO或 Y2O3。在 >
1500℃形成立方晶型固溶体,称稳定化立方ZrO2.b、熔点高(2680℃),作耐火材料.c、利用导氧导电
性能,作氧敏传感器元件.d、利用体积效应,对陶瓷材料进行相变增韧。
考点六 二元系统
(1)具有低共熔点的二元系统相图
(Ⅰ)点线面的理解
(Ⅱ)析晶路线的分析
(2)杠杆规则
(Ⅰ)T2:S%=M2L2/S2L2×100%,
L%=M2S2/S2L2×100%
(Ⅱ)刚到TE:S% =MEE/SEE×100%;
L% =MESE/SEE×100%
例题:具有不一致熔融化合物的二元系统,在低共熔点E发生如下析晶过程:L A+AmBn,E
点B含量为20%。化合物AmBn含B64%。今有C1B含量是C2B含量的1.5倍,且高温熔融冷却析
晶时,从该二配料中析出的初晶(到达低共熔温度前析出的第一种晶体)含量相等。试求C1和C2的组
100
①质原因:曲率差别产生ΔP
②条件:颗粒足够小,r<10μm
③颈部生长速率关系式
表面凹凸不平的固体颗粒,其凸处呈正压,凹处呈负压,故存在着使物质自凸处向凹处迁移。
x
r=(
3槡πγM
3/2P0
槡2R
3/2T3/2d2
)
1/3
.γ-
2
3.t
1
3
Ⅰ.x/r~t1/3,证明初期 x/r增大很快,但时间延长,很快停止。此类传质不能靠延长时间达到
烧结。
Ⅱ.温度 T增加,有利于烧结。
Ⅲ.颗粒粒度减小,愈小烧结速率愈大。
Ⅳ特点:烧结时颈部扩大,气孔形状改变,但双球之间中心距不变,因此坯体不发生收缩,密度不变。
(2)扩散传质
有应力存在时空位形成所需的附加功
Et=-γ/ρ.Ω=-σ.Ω (有张应力时)
Ec=γ/ρ.Ω=σ.Ω (有张应力时)
空位形成能:
陆佩文《无机材料学基础》考点精讲及复习思路
101
无应力时:EV
压应力区(接触点):E′V=EV+σ.Ω
张应力区(颈表面):E′V=EV-σ.Ω
结论:张应力区空位形成能<无应力区<压应力区,因而有浓度差异。
自颈部到接触点浓度差:Δ1C=Ct-Cc=2C0
σΩ
kT
自颈部到内部浓度差:Δ2C=Ct-C0=C0
σΩ
kT
结论:Ct>C0>Cc Δ1C>Δ2C
从式可见,在一定温度下空位浓度差是与表面张力成比例的,因此由扩散机理进行的烧结过程,
其推动力也是表面张力。
颈部扩大曲率ρ↑推动力ΔC↓.
空位扩散:优先由颈表面→接触点;
其次由颈表面→内部扩散
原子扩散:与空位扩散方向相反,扩散终点:颈部。
扩散可以沿颗粒表面进行表面扩散,可以沿着两颗粒之间的界面进行界面扩散,也可以在晶粒内
部进行体积扩散,在这些扩散过程中,扩散的终点都是颈部。
①初期
因为表面扩散温度<<体积扩散温度),所以表面扩散显著。
特点:气孔率大,收缩约1%。
原因:表面扩散促使空隙表面光滑和气孔球形化,对空隙的消失和烧结体收缩无明显影响。
影响以扩散为主的初始烧结因素:
Ⅰ.时间 x
r∝t
1
5 ΔLL∝t
2
5
t↑颈部扩大曲率ρ↑推动力ΔC↓延长时间不妥。
Ⅱ.原料起始粒度
x
r∝r
-35 ΔLL∝r
-65
在扩散传质的烧结过程中,控制起始粒度很重要。
102
Ⅲ.温度对烧结过程的决定性作用。
ΔL
L=(
5γΩD
kT )
2/5
r-
6
5t
2
5
自扩散系数随温度升高明显增大
烧结活化能Q值lnK=A-Q/RT
②中期:晶界和晶格扩散显著。
特点:气孔率降为5%,收缩率达80%~90%。
③后期PC=
10πDΩγ
KTL3
(tf-t)
特点:气孔完全孤立,晶粒已明显长大,坯体收缩率达90%~100%。
考点四 液态烧结
(1)流动传质
Ⅰ.粘性流动(粘性蠕变传质)
定义:由于高温下粘性液体出现牛顿型流动而产生的传质
dθ
dt=
3
2
γ
rη
(1-θ)
θ-相对密度
γ-液气表面张力
Ⅱ.塑性流动(L少)
当坯体中液相量很少或液相粘度较高时,高温下流动传质不能看成是纯牛顿型流动。而主要以
塑性流动传质为主,即只有作用力超过屈服值(f)时,流动速率
(2)溶解-沉淀传质
在烧结过程中,当固相在液相中有可溶性,将产生部分固相溶解而在另一部分固相上沉积的溶解
-沉淀传质过程。
例题:设有粉料粒度为5μm,若经2小时烧结后,x/r=0.1。如果不考虑晶粒生长,若烧结至x/r=
0.2。并分别通过蒸发-凝聚;体积扩散;粘性流动;溶解-沉淀传质,各需多少时间?若烧结8小时,
各个传质过程的颈部增长x/r又是多少?
x/r 蒸发-凝聚 扩散传质 粘性流动 溶解沉淀
运算
x/r1
x/r2
=(
t1
t2
)
1/30.1
0.2=(
2
t2
)
1/3 0.1
0.2=(
2
t2
)
1/5 0.1
0.2=(
2
t2
)
1/2 0.1
0.2=(
2
t2
)
1/6
时间 16 64 8 128
烧结时间由2小时延长至8小时
运算
0.1
x/r=(
2
8)
1/3 0.1
x/r=(
2
8)
1/5 0.1
x/r=(
2
8)
1/2 0.1
x/r=(
2
8)
1/6
x/r 0.16 0.13 0.2 0.216
例题:如上题粉料粒度改为16μm,烧结至x/r=0.2,各个传质需要多少时间?若烧结8小时时,
陆佩文《无机材料学基础》考点精讲及复习思路
103
各个传质过程的颈部增长x/r又是多少?从两题计算结果,讨论粒度与烧结时间对四种传质过程的影
响程度?
例题:烧结的主要传质方式有(A)、(B)、(C)和(D)四种。这四种传质过程的坯体线收缩 ΔL/L
与烧结时间的关系依次为(E)、(F)、(G)和(H)。
(E)△L/L=t1/3,(F)△L/L∝t2/5,
(G)△L/L∝t,(H)△L/L∝t1/3
考点五 晶粒生长与二次再结晶
(1)定义
Ⅰ.晶粒生长:材料热处理时,平均晶粒连续增大的过程。
Ⅱ.二次再结晶 (晶粒异常生长或晶粒不连续生长):少数巨大晶体在细晶消耗时成核 -长大
过程。
(2)晶粒生长
Ⅰ.实质:晶粒长大不是小晶粒相互粘结,而是晶界移动的结果;晶粒生长取决于晶界移 动的
速率。
Ⅱ.动力:晶界两边物质的自由焓之差ΔG使晶界向曲率中心移动;小
晶粒长大,界面能降低。
Ⅲ.晶粒长大定律:D2-D0
2=Kt
Ⅳ.晶粒正常长大时,如果晶界受到第二相杂质的阻碍,其移动可能出现三种情况:
104
A:晶界能量较小,晶界移动被杂质或气孔所阻挡,晶粒正常长大停止。
B:晶界具有一定的能量,晶界带动杂质或气孔继续移动,这时气孔利用晶界的快速通道排除,坯
体不断致密。
C:晶界能量大,晶界越过杂质或气孔,把气孔包裹在晶粒内部。由于气孔脱离晶界,不能利用晶
界这样的快速通道而排除,烧结停止,致密度不再增加,这时将出现二次再结晶。
Ⅴ.后期注意事项
当Vp=Vb时,要严格控制温度。在晶界上产生少量液相,可抑制晶粒长大。这是因为界面移动
推动力降低,扩散距离增加。
如果温度过高,或出现异常生长,气孔留在晶粒内而难排除。
Ⅵ.坯体理论密度与实际密度存在差异的原因及晶粒长大是否无止境?
气孔不能完全排除。随烧结进行,T升高,气孔逐渐缩小,气孔内压增大,当等于2γ/r时,烧结停
止。但温度继续升高,引起膨胀,对烧结不利。采取措施气氛烧结、真空烧结、热压烧结等。
(3)二次再结晶
原因:主要是原始物料粒度不均匀及烧结温度偏高
采取措施:控制温度(抑制晶界移动速率)、起始粉料粒度分布均匀、加入少量晶界移动抑制剂
(MgO加入到Al2O3)。
晶粒生长公式为:G3-G30=Kt
注意:并不是任何情况下二次再结晶过程都是有害的。如:铁氧体硬磁材料 BaFe12O19的烧结中,
控制大晶粒为二次再结晶的晶核,利用二次再结晶形成择优取向,使磁畴取向一致,从而得到高磁导
率的硬磁材料。
例题:在制造透明Al2O3材料时,原始粉料粒度为2μm,烧结至最高温度保温0.5小时,测得晶粒
尺寸为10μm,试问若保温2小时,晶粒尺寸多大?为抑制晶粒生长加入0.1%MgO,此时若保温2小
时,晶粒尺寸又多大?
分析:晶粒正常长大计算式:D2-D0
2=Kt
加入抑制剂晶粒长大计算式:D3-D0
3=Kt
答案:分别约20μm和15.84μm。
例题:在1500℃ Al2O3正常晶粒生长期间,观察到晶体在1小时内从0.5μm直径长大到10μm。如已
知晶界扩散激活能为335kJ/mol,试预测在1700℃下4小时后,晶粒尺寸是多少?你估计加入0.5%MgO杂
陆佩文《无机材料学基础》考点精讲及复习思路
105
质对Al2O3晶粒生长速率有什么影响?在与上面相同条件下烧结,会有什么结果,为什么?
分析:晶粒正常生长计算式:D2-D0
2=Kt
K1=Aexp(-Q/RT)
推出D1=63μm,D
3-D0
3=K2t
加入抑制剂计算式:K2=Aexp(-Q/RT2)
K1=99.75,由K式作比较得K2=998.6,
推出D2=16μm。
(4)晶界在烧结中的应用
晶界上溶质的偏聚可以延缓晶界的移动。
晶界对扩散传质烧结过程是有利的。
考点六 影响烧结的因素
(1)原始粉料粒度(细而均匀)
烧结的传质机理和实验现象都说明原料粒度越细越均匀,烧结性会好。
例如:解释曲线图空旷粒度越细,温度越高,烧结越易进行,因为颗粒粒度小,其表面能大,烧结推
动力增强。
(2)外加剂(适量)的作用
Ⅰ.外加剂与烧结主体形成固溶体
两者离子产生的晶格畸变程度越大,越有利于烧结。
例:Al2O3中加入3%Cr2O3可在1860℃烧结;当加入1~2%TiO2只需在约1600℃就能致密化。
106
原因:在Al2O3烧结中,通常加入少量 Cr2O3促进烧结,因为 Cr2O3与 Al2O3中正离子半径相近,能
形成连续固溶体之故,当加入TiO2时促进烧结温度可以更低,因为除了 Ti
4+离子与 Al3+大小相同,能
与Al2O3固溶外,还由于Ti
4+离子与 Al3+电价不同,置换后将伴随有正离子空位产生,而且在高温下
Ti4+可能转变成半径较大的Ti3+从而加剧晶格畸变,使活性更高,从而促进烧结。
Ⅱ.外加剂与烧结主体形成液相
烧结时若有适当的液相,往往会大大促进颗粒重排和传质过程;能在较低温度下产生液相,以促
进烧结。液相的出现,可能是添加物本身熔点较低;也可能与烧结物形成多元低共熔物。
例:制95%Al2O3材料,加入CaO、SiO2,
当CaO:SiO2=1时,产生液相在1540℃即可烧结。
制备MgO瓷时,加入V2O5或CuO,促使液相的生成。
Ⅲ.外加剂与烧结主体形成化合物(抑制晶界移动)
例如:在烧结透明氧化铝制品时,如果在氧化铝中加入少量MgO,可形成镁铝尖晶石分布于Al2O3
颗粒之间,抑制了晶粒长大,并促使气孔的排除,因此可以获得充分致密的氧化铝多晶体。
Ⅳ.外加剂阻止多晶转变
例:ZrO2中加入5%CaO,抑制晶型转变,使之致密化。
Ⅴ.外加剂(适量)起扩大烧结范围的作用
例:在锆钛酸铅材料中加入适量La2O3和Nb2O5,可使烧结范围由20~40℃ 增加到80℃。
(3)烧结温度和保温时间
延长烧结时间一般都会不同程度地促使烧结完成,然而在烧结后期,不合理地延长烧结时间,有
时会加剧二次再结晶作用,反而得不到充分致密的制品。
结论:高温短时间烧结是
制造致密陶瓷材料的好方法。
但烧成制度的确定必须综合考虑。
(4)盐类的选择及其煅烧条件
Ⅰ.煅烧条件
低温煅烧MgO,晶格常数大,结构缺陷比较多。
陆佩文《无机材料学基础》考点精讲及复习思路
107
结论:煅烧温度愈高,烧结活性愈低的原因是:由于MgO的结晶良好,烧结活化能增高所造成的。
Ⅱ.盐类的选择
结论:用能够生成粒度小、晶格常数较大、微晶较小、结构松弛的 MgO的原料盐来获得活性 MgO,
其烧结活性良好。
例题:氧化铝烧结到接近理论密度时,可使可见光几乎透过100%,用它来装钠蒸气(在超过大气
压的压力下)作为路灯。为通过烧结实现这一点,请你列出研究方案。
答:制备透明氧化铝陶瓷的主要技术措施是:(1)采用高纯氧化铝原料,Al2O3>99.9%,无杂质和
玻璃相;(2)添加0.1~0.5%MgO,在晶粒表面生成镁铝尖晶石,降低晶界移动速度,抑制晶粒生长;
(3)在氢气或真空中烧结,促进气孔扩散;(4)采用热压烧结,提高制品致密度。
例题:如果要合成镁铝尖晶石,可供选择的原料为 Mg(OH)2、MgO、γ-Al2O3、α-Al2O3,从提高
反应速率的角度出发,选择什么原料较好?请说明原因。
答:选择Mg(OH)2、γ-Al2O3;利用热分解、脱水、多晶转变等过程使原料反应活性提高,结构不
稳定,引起晶格活化、缺陷增多,反应和扩散能力均增强。
例题:固相烧结的扩散传质模型中,原子(离子)的迁移方向由颗粒接触点向 迁移,从
而达到气孔填充的结果。
例题:溶解-沉淀传质-在有固液两相的烧结中,当固相在液相中有可溶性,此时的烧结传质过
程为部分固相溶解,而在另一部分固相上沉积,直至晶粒长大、颗粒重排获得致密的烧结体。
练习题:1)陶瓷的显微结构主要由哪些基本因子构成?2)有哪些方法可检测 CaO-Al2O3-SiO2
系玻璃陶瓷的显微结构?冷却过程中此材料的显微结构会如何发生变化?请简要说明。
答:1)陶瓷是由晶体、玻璃体和气孔组成的多晶多相材料。其显微结构包括晶体的种类和含量,
晶粒尺寸和形状,玻璃相的含量和分布情况,晶粒之间、晶粒与玻璃相之间的界面,气孔的数量、尺寸、
分布等。2)可以用XRD确定CaO-Al2O3-SiO2系玻璃陶瓷中晶相的种类和含量,用SEM、TEM、偏光
显微镜直接观察其晶粒尺寸和形状、玻璃相的含量和分布情况、界面等显微结构,还可以通过测定晶
108
化前后的密度、热膨胀系数、强度等性质的变化情况,间接判断其显微结构变化情况。
因为在CaO-Al2O3-SiO2三元系统中,能够形成玻璃陶瓷(微晶玻璃)的组成点位于高硅区,主
要晶相是硅灰石,次要晶相是磷石英和钙长石。若结晶速度较快,冷却时先从熔体中析出晶核,很快
生长成为晶体,晶粒数量少、尺寸大,晶粒分散在玻璃相中;若结晶速度较慢时,冷却过程中仅形成少
量晶体,需要重新进行热处理,先在较低的温度下核化,再在较高的温度下晶化,才能形成玻璃陶瓷,
晶粒数量多、尺寸小,晶粒分散在玻璃相中。
例题:为得到高质量的钛酸钙电介质瓷,制备工艺中可采取什么措施?
答:为得到高质量的钛酸钙电介质瓷,主要措施:(1)原料球磨后应烘干,不能过滤脱水,防止 Ca
(OH)2流失影响配比;(2)添加少量ZrO2和CoO,降低烧成温度,扩大烧结温度范围;(3)必须在氧化
气氛中合成原料或烧结,防止产生非化学计量化合物,影响电性能;(4)控制好烧结温度和保温时间,
防止晶粒长大,使产品“正烧”,防止“生烧”和“过烧”,以降低气孔率。
4.本章历年经典试题回顾
(武汉理工大学2007、一(11)、2分)晶粒长大
(武汉理工大学2008、七、10分)烧结时加入少量FeO,在氢气氛和氧分压低时都不能促进烧结,
只有在氧分压高的气氛下才能促进烧结,试分析其原因。
(武汉理工大学2008、一、2分)烧结的中后期,正常晶粒长大的推动力为 (),它是指()。
(武汉理工大学2009、七(3)、10分)在什么样的气氛下烧结,才能获得TiO2-x,写出反应方程式,
TiO2-x是半导体,实际上产中如何控制其电导率,为什么
(武汉理工大学200910分)在Al2O3烧结中,加入少量TiO2可以明显降低烧结温度,促进烧结,请
用缺陷理论分析其原因。
(武汉理工大学2009)烧结的推动力是系统的表面能降低,它可以通过扩散传质、( )、( )
( )方式推动物质的迁移。
(武汉理工大学2010、一、4分)初次在结晶和二次在结晶
(武汉理工大学2010、八、5分)试简要说明原始粉料的粒度、物料活性、添加物、气氛、压力等因素
对烧结的影响规律。
(武汉理工大学2011、八、10分)实践证明,少量添加物常会明显地改变Al2O3烧结温度,其中原因
之一可能是因为添加物与烧结物形成固溶体。为什么与烧结物能生成固溶体的添加物能促进烧结?
在Al2O3烧结中,通常加入少量TiO2或Cr2O3促进烧结,当加入 TiO2时,烧结温度可以更低。请解释原
因(用缺陷方程来表示)。
(江苏大学2012 3分)材料烧结时,结构缺陷多一些对坯体的致密化过程是有利的。
(江苏大学2012 4分)烧结的蒸发-凝聚传质机制
(12分2012年 江苏大学)在制备氧化铝陶瓷时常常加入MgO、CaO+SiO2、Cr2O3及TiO2等作为烧
陆佩文《无机材料学基础》考点精讲及复习思路
109
结助剂。试分析以上各种烧结助剂在氧化铝烧结时的作用机理(形成固溶体、化合物、低共熔液相等)
和促进烧结的原因,写出相应的化学反应方程式或缺陷反应方程式。
(武汉科技大学2012)热压烧结与活化烧结
(江西理工大学 20113分)烧结
(江西理工大学 20118分)如果要合成锂锰尖晶石(LiMn2O4),可供选择的原料为Li2CO3、LiOH、
MnCO3、MnO2,从提高反应速率的角度出发,选择什么原料较好?请说明原因。
(江西理工大学 20118分)影响烧结的因素有哪些?最易控制的因素是哪几个?
(江西理工大学 20123分)烧结
(江西理工大学 201210分)在1500℃MgO正常晶粒长大期间,观察到晶体在1h内从1μm直径
长大到。如已知晶界扩散能为251.21kJ/mol,试预测在1600℃保持4h后晶粒的大小,并估计杂质对
MgO晶粒生长速率有什么影响,为什么?
(山东建筑大学20113分)烧结
(山东建筑大学20116分)烧结过程的推动力是 。
烧结致密体是一种多晶材料,其显微机构由 、 、 构成。
固相烧结过程中,蒸发-凝聚传质产生的原因为 ,扩散传质产生的原因为 。
(山东建筑大学20126分)晶粒生长和二次再结晶
(山东建筑大学201216分)烧结过程中有哪些传质方式?试简述其产生的原因以及特点。
(四川大学20075分)再结晶
(南京工业大学2004)烧结的四种传质机理是蒸发凝聚 ,扩散传质,流动传质,溶解沉淀,对应的
动力学关系式△L/L0=0、△L/L0∝t
2/5、△L/L0∝t、#L/L0∝t
1/3。
(南京工业大学2008)烧结是一个包含了多种物理和化学变化的过程。( )
(南京工业大学2008)烧结过程的推动力是晶界能大于表面能。
(南京工业大学 2008)在烧结过程中,只改变气孔性质而不引起坯体收缩的传质方式是
。
A.扩散传质 b.流动传质
c.蒸发-凝聚传质 d.晶界传质
(南京工业大学2008)烧结的四种传质机理是蒸发凝聚 ,扩散传质,流动传质,溶解沉淀,对应的
动力学关系式△L/L0=0、△L/L0∝t
2/5、△L/L0∝t、#L/L0∝t
1/3。
(南京工业大学2008)名词解释:烧结
(南京工业大学2008)某一粉末压块,其粉末评价粒径为2μm,烧结至最高温度保湿0.5h,测得晶
粒尺寸为10μm,试问若保温2h,晶粒尺寸多大?为抑制晶粒生长加入0.1%晶粒生长抑制剂,若也保
温2h,晶粒尺寸为多大?
(南京工业大学2008)何为晶粒生长与二次再结晶,简述造成二次再结晶的原因和防止二次再结
110
晶的方法。
(南京工业大学2009)在烧结过程中个,只改变气孔形状而不引起坯体收缩的传质方式是
。a扩散传质b流动传质c蒸发-凝聚传质d晶界传质
(南京工业大学2009)有液相存在的烧结过程称为液相烧结。
二次再结晶是指( ),造成二次再结晶的原因有( )、( )和( )等。
(南京工业大学2009)试比较固相烧结和液相烧结之间的相同与不同之处,并讨论产生溶解 -沉
淀传质的条件与特点。
(南京航空航天大学2004 4分)晶粒大小对材料的力学性能有什么影响,在实际生产中常采用
哪些措施来控制晶粒生长。
(南京航空航天大学2004 4分)比较间隙固溶体、间隙相和间隙化合物的异同点。
(北京工业大学20121分)有液相存在的烧结过程称为液相烧结。( )
(吉林大学200510分)烧结的驱动力是什么?烧结中传质方式主要有哪几种?各种传质的驱动
力是什么?哪种传质方式可不引起体积的收缩?
5.本章小结
本章类型题包括名词解释(烧结、热压烧结、活化烧结、晶粒生长、二次再结晶)、填空题、问答题
(四种传质机理的特点、扩散传质的过程、烧结过程中,分析晶界遇到夹杂物时会出现的情况,从致密
化目的考虑,晶界应如何移动?怎样控制等。影响烧结的因素,其中最重要的是添加剂的作用)、计算
题(晶粒大小、生长时间)。缩略图:
当前页面二维码





 工程招标采购
工程招标采购 搞笑表情
搞笑表情 微信头像
微信头像 美女图片
美女图片 APP小游戏
APP小游戏 PPT模板
PPT模板