流式细胞仪检测细胞凋亡操作流程.pdf
- 文件大小: 1.52MB
- 文件类型: pdf
- 上传日期: 2025-08-25
- 下载次数: 0
概要信息:
流式检测细胞凋亡
Annexin V 检测细胞凋亡 ........................................................................................2
实验原理................................................................................................................2
实验用品................................................................................................................2
操作步骤................................................................................................................3
Annexin V Blocking ..............................................................................................5
凋亡细胞的 DNA 断裂片段分析 .............................................................................7
实验原理................................................................................................................7
实验用品................................................................................................................8
操作步骤................................................................................................................9
BrdU Flow Kits 检测细胞增殖 ..............................................................................12
实验原理..............................................................................................................12
BrdU Flow Kits 试剂盒.......................................................................................12
结果分析..............................................................................................................17
流式仪器设置指南..............................................................................................18
线粒体膜电位变化检测细胞凋亡..........................................................................22
实验原理..............................................................................................................22
实验用品..............................................................................................................22
样本制备..............................................................................................................23
结果分析..............................................................................................................24
注意事项..............................................................................................................24
Active Caspase-3 检测细胞凋亡 ...........................................................................26
实验原理..............................................................................................................26
实验步骤..............................................................................................................27
结果分析..............................................................................................................28
1
Annexin V 检测细胞凋亡
实验原理
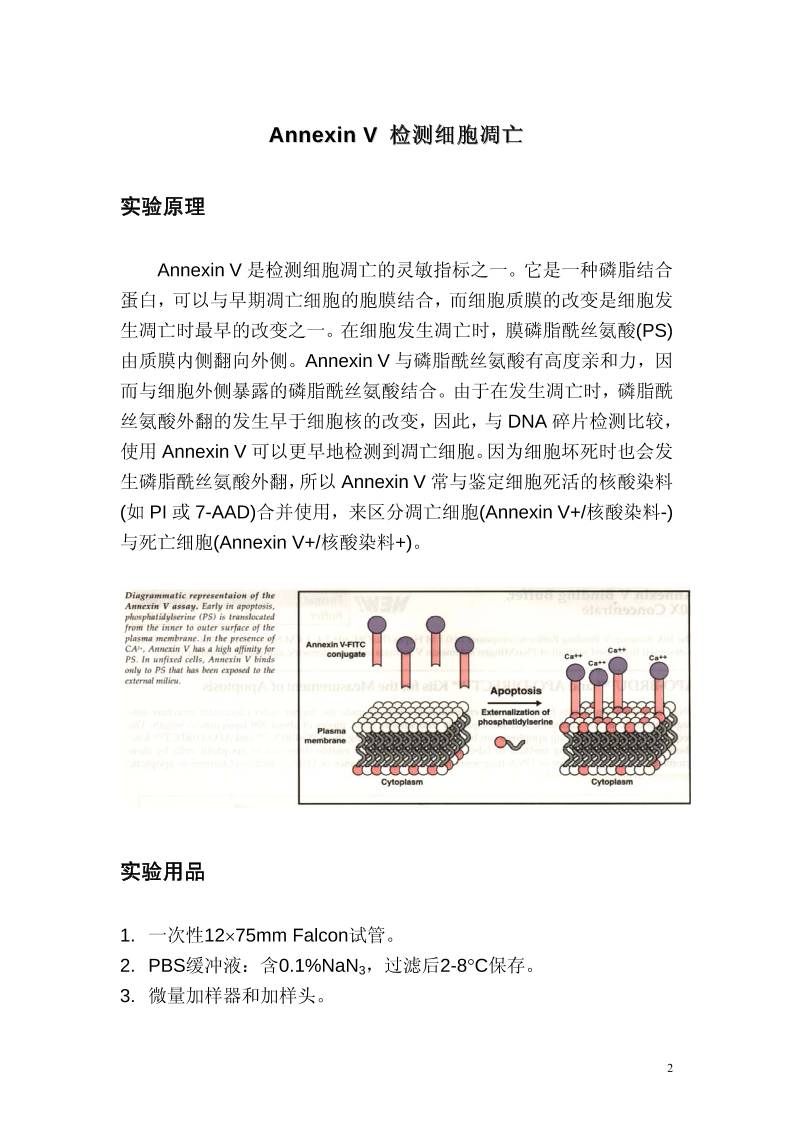
Annexin V 是检测细胞凋亡的灵敏指标之一。它是一种磷脂结合
蛋白,可以与早期凋亡细胞的胞膜结合,而细胞质膜的改变是细胞发
生凋亡时 早的改变之一。在细胞发生凋亡时,膜磷脂酰丝氨酸(PS)
由质膜内侧翻向外侧。Annexin V 与磷脂酰丝氨酸有高度亲和力,因
而与细胞外侧暴露的磷脂酰丝氨酸结合。由于在发生凋亡时,磷脂酰
丝氨酸外翻的发生早于细胞核的改变,因此,与 DNA 碎片检测比较,
使用 Annexin V 可以更早地检测到凋亡细胞。因为细胞坏死时也会发
生磷脂酰丝氨酸外翻,所以 Annexin V 常与鉴定细胞死活的核酸染料
(如 PI 或 7-AAD)合并使用,来区分凋亡细胞(Annexin V+/核酸染料-)
与死亡细胞(Annexin V+/核酸染料+)。
实验用品
1. 一次性12×75mm Falcon试管。
2. PBS缓冲液:含0.1%NaN3,过滤后2-8°C保存。
3. 微量加样器和加样头。
2
4. Annexin V Binding Buffer缓冲液(Cat. No. 66121E):浓度为
10×,使用时,用稀释为1×浓度的应用液。
5. Annexin V试剂与核酸染料:
Annexin V 核酸染料
Annexin V-Biotin(Cat. No. 65872X)
Streptavidin-FITC(Cat. No. 13024D)
PI(Cat. No. 66211E)或
7-AAD(Cat. No. 34321X)
Annexin V-FITC(Cat. No. 65874X) PI(Cat. No. 66211E)
Annexin V-PE(Cat. No. 65875X) 7-AAD(Cat. No. 34321X)
6. FACS流式细胞仪:上样检测。
7. CELLQuest软件:获取和分析试验数据。
8. Annexin V检测对照管:
Annexin V A-阴性对照 B-补偿 1 C-补偿 2
Biotin SAv-FITC Annexin V-Biotin
和 SAv-FITC
PI 和
SAv-FITC
PE 未染色细胞 Annexin V-PE 7-AAD
FITC 未染色细胞 Annexin V-FITC PI
操作步骤
1. 取 Falcon 试管,按标本顺序编好阴性对照管和标本管号。
2. 使用冷的PBS缓冲液洗细胞两次,再用1× Binding Buffer缓冲液制成1×106
细胞/ml的悬液。
3. Falcon试管中加入100 µl细胞悬液。
4. 按以下体积加入Annexin V与核酸染料:
管号 名称 荧光标记 Annexin V 核酸染料:
1 阴性对照 - -
2 单阳 1 AV-FITC -
3 单阳 2 - PI
4 样本 AV-FITC PI
5. 轻轻混匀,室温(20°C ~25°C)避光处放置15分钟。
3
6. *使用Annexin V-Biotin试剂进行检测时:
h 1×Binding Buffer缓冲液洗细胞一次,去上清。
h 1×Binding Buffer缓冲液100µl溶解SAv-FITC试剂0.5µg,加入到细胞管中。
h 轻轻混匀。
h 加入5µl PI,室温(20-25°C)避光处放置15分钟。
7. 各试验管中分别加入1×Binding Buffer缓冲液400µl。
8. 1小时内上流式细胞仪测定结果。
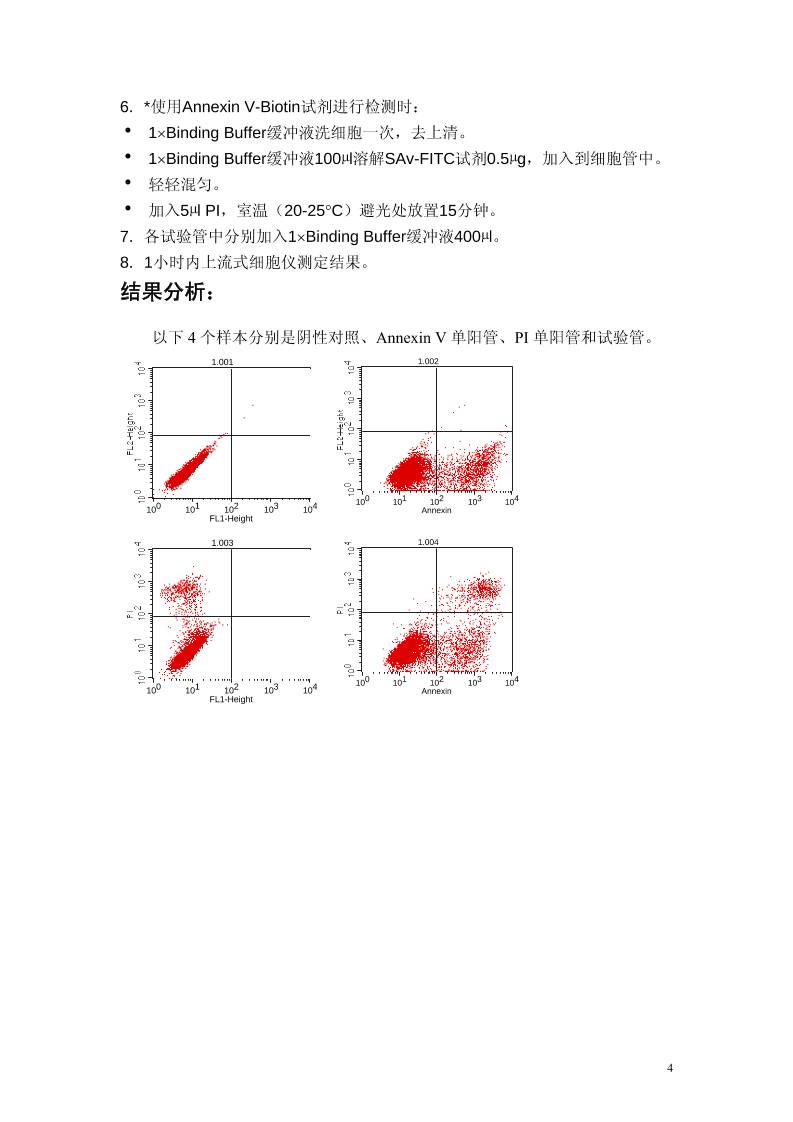
结果分析:
以下 4 个样本分别是阴性对照、Annexin V 单阳管、PI 单阳管和试验管。
100 101 102 103 104
FL1-Height
1.001
100 101 102 103 104
Annexin
1.002
100 101 102 103 104
FL1-Height
1.003
100 101 102 103 104
Annexin
1.004
4
Annexin V Blocking
待测细胞与未标记的重组 Annexin V 预孵育,然后进行实验,是 Annexin V
细胞凋亡检测的质量控制。原理是预先阻断 Annexin V-FITC 的结合位点,这样
可以证明 Annexin V-FITC 凋亡分析的特异性。
1. 使用冷的PBS缓冲液洗细胞两次,再用1×Binding Buffer缓冲液制成1×106
细胞/ml的悬液。
2. 在5ml的培养管中加入100µl细胞悬液(约1×105个细胞)。
3. 加入5-15µg纯化的重组Annexin V。注意,不同的细胞系,以及凋亡的不同
阶段,其Annexin V位点饱和所需要的纯化的重组Annexin V含量不同。某些
情况下,为达到 好效果,可以减少细胞数量,0.5×105个细胞加5-15µg纯
化的重组Annexin V。
4. 轻轻混匀,室温反应15分钟。
5. 加入5µl的Annexin V-FITC或/和PI,轻轻混匀,室温避光处放置15分钟。
6. 各试验管中分别加入1×Binding Buffer缓冲液400µl。
7. 1小时内上流式细胞仪测定结果。
8. 结果分析:
下图 A、B 为 Anti-Fas 抗体诱导 3 小时后的 Jurkat T 细胞, 图 C、D 为
未处理的细胞;图 A、C 为 Annexin V-FITC 染色的凋亡检测结果,图 B、D
为 Annexin V Blocking 后的检测结果。
5
PharMingen 推荐 Annexin V 细胞凋亡检测试剂盒
规格 货号
Annexin V-FITC Apoptosis Detection Kit I:
Part A:Annexin V-FITC(100 tests)
PI (2ml)
1×Binding Buffer 缓冲液(50ml)
100tests 6693KK
Annexin V-FITC Apoptosis Detection Kit II (Annexin V
Blocking):
Part A:Annexin V-FITC(100 tests)
PI (2ml)
1×Binding Buffer 缓冲液(50ml)
Part B:Purified Recombinant Annexin V(100µg)
100tests 6710KK
6
凋亡细胞的 DNA 断裂片段分析
实验原理
在细胞发生凋亡后, 早出现胞膜外翻等现象,之后发生的程序性改变之一,
就是细胞核酸内切酶激活,出现 DNA 断裂片段。核酸酶将染色质的高级结构断
裂为 50-300kb 的片段, 终断裂为 200bp 大小的 DNA 碎片。DNA 碎片检测的
方法是外源性 TdT 酶催化反应,常指“end-labeling”或“TUNEL” (terminal
deoxynucleotidyltransferase dUTP nick end labeling)。现在可以使用 APO-DIRECT
Kit,用流式细胞术来检测凋亡细胞由于 DNA 断裂,造成 DNA 链 3’-OH 增多的
情况。
在 APO- DIRECT 分析中,TdT 酶催化 DNA 单链和双链 3’-OH 末端非模板
依赖性的 dUTP FITC 掺入反应。由于采用了直接荧光标记的 FITC-dUTP,所以
一步反应后,就可以在流式细胞仪上检测 DNA 碎片。
7
APO-DIRECT Kit(Cat. No. 6536KK)试剂盒:
Part A(4°C 保存) PI/RNase A Solution
Reaction Buffer
Rinsing Buffer
Wash Buffer
Part B(-20°C 保存) FITC-dUTP
TdT Enzyme
Negative Control Cells:已固定细胞
Positive Control Cells:已固定细胞
实验用品
1. 一次性 12×75mm Falcon 试管
2. 蒸馏水
3. PBS 缓冲液:含 0.1%NaN3,过滤后 2-8°C 保存
4. 固定液:含 1%多聚甲醛的 PBS 缓冲液
5. 70%乙醇
6. 冰浴箱
7. 微量加样器和加样头
8. APO-DIRECT Kit 试剂盒
9. 流式上机检测
8
操作步骤
1. 细胞固定:
(1) 用 PBS 洗细胞后,将细胞重悬于 1%多聚甲醛中,浓度为 1-2×106/ml,冰浴
30-60 分钟。
(2) 300×g 离心 5 分钟,弃上清。
(3) 用 5ml PBS 洗细胞两次,重悬于 70%乙醇中,浓度为 1-2×106/ml,冰浴 30-60
分钟。(70%乙醇细胞悬液在-20°C 放置 12-18 小时后进行细胞凋亡检测,
得到的效果 好。细胞可以在-20°C 保存几个月。)
2. 配制染色液,现用现配。
DNA 标记液 1 个测试 6 个测试 12 个测试
Reaction Buffer 10.00μl 60.00μl 120.00μl
TdT Enzyme 0.75μl 4.50μl 9.00μl
FITC-dUTP 8.00μl 48.00μl 96.00μl
蒸馏水 32.00μl 192.00μl 384.00μl
总体积 50.75μl 305.50μl 609.00μl
3. 细胞染色:
(1)取离心管和 Falcon 试管,按标本顺序编号。
9
(2)取 1×106细胞悬液加入离心管中,300×g 离心 5 分钟,弃去乙醇,留下沉积细
胞。
质控细胞(Negative Control Cells、Positive Control Cells):混匀后取 1ml
(细胞数约 1×106/ml)加入离心管中,300×g 离心 5 分钟,弃去乙醇,留下
沉积细胞。
(3) 每管各加入 1.0ml Wash Buffer,洗细胞两遍,弃上清。
(4) 加入染色液 50μl,混匀。
(5) 37°C 温育 60 分钟(或者室温过夜),每 15 分钟摇匀一次。(非质控细胞
37°C 温育时间需根据不同情况有所凋整。)
(6) 各管加入 1.0ml Rinse Buffer,300×g 离心 5 分钟,弃上清。重复两遍,弃去
上清。
(7) 加入 0.5ml PI/RNase A Solution,混匀。若细胞浓度低,可将用量调整到
0.3ml。
(8) 室温避光处反应 30 分钟。
(9) 3 小时内上流式细胞仪测定结果。
4. 结果分析:PI 测定细胞 DNA 含量,FITC-BrdU 测定调亡。
做 DNA-W/DNA-A 点图和 DNA-A/FITC-BrdU 点图,进行数据获取。取单个细
胞门(DNA-W/DNA-A 设门),分析 BrdU 直方图,获得细胞凋亡信息。同时,可
分析细胞周期(DNA-A)与细胞凋亡(BrdU)的关系。
10
5. 阴性质控细胞 Negative Control Cells 和阳性质控细胞 Positive Control Cells:
11
BrdU Flow Kits 检测细胞增殖
实验原理
BrdU中文全名5-溴脱氧尿嘧啶核苷,为胸腺嘧啶的衍生物,可代替胸
腺嘧啶在DNA合成期(S期),活体注射或细胞培养加入,而后利用抗Brdu
单克隆抗体,荧光染色,显示增殖细胞。同时结合其它细胞标记物,可判
断增殖细胞的种类,增殖速度,对研究细胞动力学有重要意义。BrdU Flow
Kits是用 BrdU染色和流式分析结合高效的试剂盒,包括在BrdU 存在下培
养细胞,以适宜浓度的DNA 酶使胞内DNA 变性,加强掺入BrdU 与抗体
的亲和力,同时保留胞内蛋白结构和荧光素荧光强度,从而避免了DNA 变
性条件与胞内及表面标志同时检测条件的冲突,运用荧光标记的抗细胞表
面抗原单抗及抗细胞因子单抗,结合固定、破膜、通透等处理技术使同时检
测细胞活化、增殖、DNA 合成及胞内细胞因子的分泌成为可能。7-AAD染
色总DNA,通过BrdU和7-AAD双色染色就能刻画中细胞在整个细胞周期中
增殖时期的特点。
BrdU Flow Kits 试剂盒
FITC BrdU Flow Kit
Cat. No. 559619 (50 tests) Cat. No. 557891 (4×50 tests)
APC BrdU Flow Kit
Cat. No. 552598 (50 tests) Cat. No. 557892 (4×50 tests)
1. 抗BrdU荧光抗体
每管50μl 染色50 样本(106 cells/样本). FITC BrdU Flow Kit(Cat.
No. 559619) 包含50μl FITC anti-BrdU抗体。APC BrdU Flow Kit (Cat. No.
12
552598), 包含50 μl APC anti-BrdU抗体。抗体使用前用 BD Perm/Wash
Buffer按照1:50稀释。每个样本加入50 μl 稀释抗体。
2. BD Cytofix/Cytoperm™ Buffer
一步法固定透膜试剂用于进行细胞内染色。此试剂维持细胞形态,固
定细胞蛋白,为下一步胞内染色进行透膜。
3. BD Perm/Wash Buffer
10×浓缩液,使用时用去离子水按照1:10稀释。Perm/Wash Buffer (1
×)只能用于固定好的细胞,在未固定的细胞使用该试剂会造成细胞的损
伤。
4. BD Cytoperm™ Plus Buffer
BD Cytoperm Plus Buffer 作为染色增强和二次破膜试剂(100 μ
l/sample)。只能用于固定好的细胞。
BrdU
每个瓶含有0.5ml的10 mg/ml BrdU,稀释于1×DPBS中的(32.5 mM)溶
液。无菌制备所提供的BrdU溶液,(0.22 μm 过滤)其不含有防腐剂;因此
推荐在无菌条件下处理该溶液。该母液可以通过腹膜内(i.p.)注射于动物
或者稀释到1 mM溶液用于体外标记。对于通过i.p.注射的体内标记,参见手
册的体内标记部分(第11页)。为了在体外标记细胞,首先通过将31 μl
加入到1ml的1×DPBS或者培养基中(这是32×稀释)将母液(10 mg/ml BrdU
溶液)稀释到1mM溶液。将10 μl的1 mM溶液加入到每ml培养基中以获得的
10 μM 终浓度。BrdU的分子量为307.1。提供5瓶BrdU溶液,并且储存在
–80°C。
注意:已经证实BrdU溶液在4˚C下可以稳定长达4个月或者可以再冷冻。
避免多次冰冻循环。
5. DNase
. 每个瓶中含有300 μl的DNase在1×DPBS中的1 mg/ml溶液。当着色
10个或更多样品时,解冻整瓶DNase溶液,加入700 μl的1×DPBS以制备
300 μg/ml的工作母液。
注意:如果使用DNase处理少于10个样品,取30 μl等份的(1 mg/ml)
DNase溶液/样品,并在–80°C下再冷冻剩余的1 mg/ml DNase。
13
注意:DNase母液(即,1 mg DNase/ml)在失活前可以再冷冻一次。
使用总计100 μl的工作母液处理每个细胞样品(即,30 μg DNase/ 106细
胞),在37°C下进行培育。提供5瓶DNase,并且储存在–80°C。
6. 7-AAD.
每个样本用20 μl 7-AAD染色 (106 cells/样本)。
7. Staining Buffer(未提供)
1×DPBS + 3% 灭活的胎牛血清FBS + 0.09%叠氮化钠.
Note: BD Pharmingen™ Stain Buffer (FBS) (Cat. No.
554656)
实验步骤
14
一. BrdU体外标记培养的细胞和细胞系
体外标记细胞,每毫升组织培养液中小心加入10 μl BrdU solution (1 mM BrdU in
1×DPBS)这步重要的是避免各种方面对细胞的干扰(例如离心步骤或温度变化)。这
些都可能干扰细胞正常周期。. 细胞培养的密度不要超过2×106 cells/ml 。 孵育足够的
时间。脉冲标记实验中时间点和脉冲时间长度的选择依赖于实验细胞群的细胞周期开始
和进展的速度。例如对于活跃增殖细胞系处于对数生长期时(例如, CTLL-2 cells)有效的
脉冲时间长度是30-45分钟。
二. BrdU Flow Kit 染色步骤
1.染色表面抗原
a. 加入BrdU冲击后细胞 (10
6
细胞 / 50μl staining buffer)到流式管
b. 加入含有表面分子抗体staining buffer 50 μl混匀。
c. 冰浴15分钟。
d. 加入 1 ml staining buffer 洗细胞,300×g 离心 5分钟,弃上清。
2. 用BD Cytofix/Cytoperm Buffer对细胞进行固定和破膜。
a. 用 100 μl BD Cytofix/Cytoperm Buffer重悬细胞。
b. 室温或冰浴15-30分钟。
c. 加入1 ml staining buffer洗细胞,300×g离心5分钟,弃上清。
3. 用 BD Cytoperm Plus Buffer孵育细胞.
a. 用 100 μl BD Cytoperm Plus Buffer重悬细胞
b. 冰浴10分钟
c. 加入1 ml staining buffer洗细胞,300×g离心5分钟,弃上清。
4. 再次固定细胞
a. 用 100 μl of BD Cytofix/Cytoperm Buffer重悬细胞
b. 室温或冰浴5分钟。
c. 加入1 ml staining buffer洗细胞,300×g离心5分钟,弃上清。
5. 处理细胞暴露出掺入的BrdU
15
a. 重悬细胞用100μl稀释的 DNase (DPBS稀释成 300 μg/ml ),即每管30 μ
g DNase。
b. 37°C孵育细胞1小时。
c. 加入1 ml staining buffer洗细胞,300×g离心5分钟,弃上清。
6. 用荧光抗体染色BrdU和胞内抗原
a. 用 50μl BD Perm/Wash Buffer重悬细胞,其中包含有稀释的anti-BrdU 和
/或胞内特异的抗原的荧光抗体。
b. 室温孵育细胞20分钟
c. 加入1 ml staining buffer洗细胞,300×g离心5分钟,弃上清。
7. 可选项 —染色全部DNA进行细胞周期分析
加入 20 μl 7-AAD重悬细胞。
8. 重悬细胞进行流式分析
a. 每管加入1 ml staining buffer 重悬细胞。
b. 流式分析染色样本 (上样速度不要超过400个/秒) 。样本可以4°C过夜。
注意:
1. 冻存液: 10%二甲基亚砜DMSO + 90%灭活胎牛血清(FBS)。
2. DNase处理后的细胞储存在 BD Perm/Wash Buffer过夜,为第二天的染色
做准备。
3. 通过识别多聚甲醛固定抗原决定簇,免疫荧光可以同时标记细胞表面和胞内
抗原。
4. 如果不用染色总DNA 7-AAD步骤可以省略,还可以在FL3进行另一荧光参数的
检测。
16
结果分析
17
流式仪器设置指南
FITC BrdU 仪器设置
18
举例样本: FITC anti-BrdU (FL1), 7-AAD (FL3), PE 同型对照(FL2), PE IL-10
或PE TNF.
1.调取Lyse/Wash mode条件,调节FSC和SSC电压到合适位置。
2.染料7-AAD在FL3检测,改为线性,通过调节FL3电压,使得G0/G1 期落入50
道上(256 线性分辨率) 或200道 ( 1024 线性分辨率) 。
3.FL1 和FL2对数模式,调整其电压使未染色组位于阴性位置。
4.补偿FITC (FL1) 发射
利用FITC anti-BrdU+ cells管调整补偿,调整FL2-FL1,使A2细胞群平行于X
轴。
19
5.补偿7-AAD (FL3) 发射
利用7-AAD+ 细胞组调整FL2-FL3的补偿,使得FL2中细胞信号都在101以下。
6.利用PE IL-10,FITC BrdU 和7-AAD三色都染后发现图形中由同型对照设定补
偿不合适。
20
7.PE IL-10调整 FL2 – %FL3 (1) andFL3–%FL2(2)补偿。使得FL2中细胞群体
处于101内。
21
线粒体膜电位变化检测细胞凋亡
实验原理
JC-1(5,5′,6,6′-Tetrachloro-1,1′,3,3′-tetraethyl-imidacarbocyanine iodide)是一
种广泛用于检测线粒体膜电位(mitochondrial membrane potential)△Ψm 的理想荧
光探针。可以检测细胞、组织或纯化的线粒体膜电位。在线粒体膜电位较高时,
JC-1 聚集在线粒体的基质(matrix)中,形成聚合物(J-aggregates),可以产生红色荧
光(FL-2 通道);在线粒体膜电位较低时,JC-1 不能聚集在线粒体的基质中,
此时 JC-1 为单体(monomer),可以产生绿色荧光(FL-1 通道)。这样就可以非
常方便地通过荧光颜色的转变来检测线粒体膜电位的变化。常用红绿荧光的相对
比例来衡量线粒体去极化的比例。
线粒体膜电位的下降是细胞凋亡早期的一个标志性事件。通过 JC-1 从红色
荧光到绿色荧光的转变可以很容易地检测到细胞膜电位的下降,同时也可以用
JC-1 从红色荧光到绿色荧光的转变作为细胞凋亡早期的一个检测指标。
JC-1 单体的 大激发波长为 514nm, 大发射波长为 527nm;JC-1 聚合物
(J-aggregates)的 大激发波长为 585nm, 大发射波长为 590nm。
实验用品
1. 12×75mm 的 Falcon 管和 15ml 聚苯乙烯离心管
2. 微量加样器和加样头
3. 线粒体检测试剂盒(货号551302,100tests),包括JC-1和10 × Assay Buffer,
注:每个 KIT 包括 4 小瓶 JC-1 试剂,每小瓶试剂足够检测 25 个样本
4. 离心机
5. CO2 培养箱
6. 流式细胞仪
22
样本制备
图 1:试剂准备和 JC-1 染色步骤总揽
1. 在JC-1粉末中加入125ulDMSO使其充分溶解,配成JC-1 Stock Solution,需根
据实验的量分装-20度保存。
2. 根据样本量配制JC-1 Working Solution,每个样品 500ul 1×Assay Buffer + 5ul
JC-1 Stock Solution。工作液应根据样本量现配现用,多余的工作液不能储存
后继续使用。
3. 制备1×106 /ml的细胞悬液, 浓度不宜过高,因为超过该浓度容易造成细胞
的凋亡。
4. 诱导细胞进行凋亡的处理,同时保留一份未经诱导的细胞作为对照。
5. 凋亡处理结束后,每个无菌的15ml聚苯乙烯离心管中加入1ml细胞悬液,室
温下,400×g ,离心5分钟,弃上清。
6. 每管加入0.5 ml 新配的JC-1工作液,充分混匀后置于37°C的CO2培养箱,孵
育10-15分钟。
7. 按以下步骤洗涤细胞两次:
23
第一次:每管加体积为 2 ml 的 1× Assay Buffer,轻轻悬浮细胞,振荡或用
枪头使细胞分散,以免细胞聚集成块。400×g ,室温离心 5 分钟,弃上清。
第二次:每管加体积为 21ml 的 1× Assay Buffer,轻轻悬浮细胞,振荡或用
枪头使细胞分散,以免细胞聚集成块。400×g ,室温离心 5 分钟,弃上清。
8. 每管加体积为0.5 ml的 1× Assay Buffer,轻轻悬浮细胞,上机检测。
结果分析
图 2. JC-1 检测 Jurkat T 细胞和小鼠胸腺细胞凋亡实验结果
A-C 为对照,细胞亚群(R1)在 FL-2 和 FL-1 通道同时显示 JC-1 的荧光信号。
D- F 显示 JC-1 在 FL-2 通道荧光信号降低的细胞亚群(R2)显著增加,证明线粒
体膜电位△Ψm 下降,细胞发生凋亡。凋亡与线粒体膜电位的去极化相关。细胞
凋亡时线粒体膜电位发生去极化,JC-1 进入线粒体以单体形式存在,仅在 Fl-1
通道有荧光。
注意事项
1. JC-1 避光保存及使用,工作液现配现用,不宜保存后继续使用。
2. 细胞培养的数量不宜超过 1×106,否则细胞会产生自然凋亡影响检测。
3. 对 PH 变化过于敏感的细胞建议用胎牛血清取代 Buffer 孵育染色及洗涤,或
延长观测时间
24
4. 流式细胞仪检测线粒体膜电位变化受到多种因素的影响,因诱导剂、细胞株
类型,作用时间的不同而荧光强度比例都有不同,因此没有通用标准的补偿设门
指南,因此每个试验需设阴性及阳性对照组进行荧光补偿及设门。
5.组织需先制备单细胞悬液或提取纯化线粒体后方可进行检测。
25
Active Caspase-3 检测细胞凋亡
实验原理
Caspase-3 在早期凋亡细胞中就已经活化,是凋亡程序中的重要的 Caspase
酶。凋亡细胞中,32kD的原酶(Pro-caspase-3)裂解为一个 17-21kD亚单位和一个
12kD 亚单位,两个亚单位形成二聚体,即为活化的 Caspase-3,活化的
Caspase-3 又水解、活化其它 Caspase 酶和多种胞浆内成分(如 D4-GDI,Bcl-2)
和核内成分(如 PARP)。
PharMingen 多克隆或单克隆 Caspase-3 抗体可以识别 Caspase-3 活化形式,
它特异性识别由无活性的 Pro-Caspase-3 活化水解后的暴露的断裂端,C92 单克
隆抗体与 Pro-Caspase-3 无交叉反应。
Active Caspase-3 Apoptosis Kit 特为流式细胞术分析凋亡细胞的 Caspase-3 而
设计。包括荧光标记多克隆兔抗 Active-Caspase-3 抗体(Anti-Active Caspase-3
FITC 或 Anti-Active Caspase-3 PE)、固定/破膜剂、破膜/冲洗缓冲液。
26
实验步骤
1 Camptothecin 诱导细胞凋亡
在 DNA 合成中,需要拓扑异构酶 I。Camptothecin 是拓扑异构酶 I 的抑制
剂,它在体外依剂量不同而影响凋亡的发生。在此,Camptothecin 做为常规的
凋亡诱导方案,辅助细胞凋亡分析。
凋亡诱导试验用品
1. 用 DMSO 制备 1.0mM 的 Camptothecin 储备液
2. Jurkat T 细胞(ATCC TIB-152)
凋亡诱导试验步骤
1. 1×106cells/ml 增殖的 Jurkat T 细胞加入 Camptothecin,Camptothecin 终浓度
为 4-6μM。
2. 细胞 37°C 孵育 4 小时。
2 Active Caspase-3 染色步骤
试验用品:
1. 12×75mm 的 Falcon 管
2. PBS 缓冲液
3. 凋亡检测试剂盒
Product Cat. No. Size
PE Active Caspase-3 Apoptosis Kit
包括:PE-conjugated Polyclonal Rabit Anti-Active Caspase-3
Antibody
Cytofix/Cytoperm Solution
Perm/Wash Buffer(10×)
550914
100
Tests
FITC Active Caspase-3 Apoptosis Kit
包括:FITC-conjugated Polyclonal Rabit Anti-Active
Caspase-3 Antibody
Cytofix/Cytoperm Solution
Perm/Wash Buffer(10×)
550480 100
Tests
染色步骤:
27
1. 计算抗体和 Perm/Wash Buffer 缓冲液用量:每个测试样本加入 100μl
Perm/Wash Buffer 缓冲液和 20μl 抗体(见下表)。
测试样本数 细胞总数 Perm/Wash Buffer 总体积
(ml)
抗体总体积(μl)
1 1×106cells 0.10 20
5 5×106cells 0.50 100
10 10×106cells 1.00 200
20 20×106cells 2.00 400
2. 根据用量制备 Perm/Wash Buffer(1×),将 10×浓度缓冲液使用蒸馏水进行
10 倍稀释,注意:有时 10×浓度的缓冲液内会出现沉淀,属正常现象,在稀
释成 1×浓度的缓冲液后,使用 0.45μ的滤器过滤即可。
3. 使用冷的 PBS 缓冲液洗细胞两次,再用 Cytofix/Cytoperm Solution 调整细胞
浓度为 1×106cells/0.5ml。
4. 细胞冰浴 20 分钟。
5. 细胞离心,弃上清。室温下,使用 1×Perm/Wash Buffer 洗细胞两次,
Perm/Wash Buffer 缓冲液的用量为 0.5ml Buffer/1×106cells。
6. 按样本数加入 1×Perm/Wash Buffer 和抗体,混匀,室温反应 30 分钟。
7. 每测试管中,用 1.0ml 的 1×Perm/Wash Buffer 洗细胞一次,再用 0.5ml 的
1×Perm/Wash Buffer 制成细胞悬液,在流式细胞仪上进行样本分析。
结果分析
未经凋亡诱导的 Jurkat cells (ATCC TIB-152) (左图)和经喜树碱诱导 4 小时
的 Jurkat cells (右图)同时上机检测。结果显示如下:左图未检测到活化的caspase-3
(左图 M2),右图超过 1/3 的 caspase-3 发生了活化(右图 M2)。证明经喜树碱处理,
Jurkat cells 发生了明显的凋亡。
28缩略图:
当前页面二维码




 工程招标采购
工程招标采购 搞笑表情
搞笑表情 微信头像
微信头像 美女图片
美女图片 APP小游戏
APP小游戏 PPT模板
PPT模板