晶体结构.pdf
- 文件大小: 281.62KB
- 文件类型: pdf
- 上传日期: 2025-08-25
- 下载次数: 0
概要信息:
湖南工学院
材料物理化学
第二章 晶体结构及常见晶体结构类型
1、名词解释
(a)晶体与晶体常数(b)类质同晶和同质多晶(c)二八面体型与三八面体型
(d)同晶取代与阳离子交换(e)尖晶石与反尖晶石(f)晶胞与晶胞参数(g)
配位数与配位体(h)同质多晶与多晶转变(i)位移性转变与重建性转变(j)晶
体场理论与配位场理论
解:(a)晶体是内部质点在三维空间成周期性重复排列的固体。或晶体是
具格子构造的固体。晶体常数:晶轴轴率或轴单位,轴角。
(b)类质同象:物质结晶时,其晶体结构中部分原有的离子或原子位置被性质
相似的其它离子或原子所占有,共同组成均匀的、呈单一相的晶体,不引起键性
和晶体结构变化的现象。
同质多晶:同一化学组成在不同热力学条件下形成结构不同的晶体的现象。
(c)二八面体型:在层状硅酸盐矿物中,若有三分之二的八面体空隙被阳离子
所填充称为二八面体型结构。
三八面体型:在层状硅酸盐矿物中,若全部的八面体空隙被阳离子所填充称为三
八面体型结构。
(d)同晶取代:杂质离子取代晶体结构中某一结点上的离子而不改变晶体结构
类型的现象。
阳离子交换:在粘土矿物中,当结构中的同晶取代主要发生在铝氧层时,一些电
价低、半径大的阳离子(如 K+、Na+等)将进入晶体
结构来平衡多余的负电荷,它们与晶体的结合不很牢固,在一定条件下可以被其
它阳离子交换。
(e)正尖晶石:在 AB2O4尖晶石型晶体结构中,若 A2+分布在四面体空隙、而
B3+分布于八面体空隙,称为正尖晶石;
反尖晶石:若 A2+分布在八面体空隙、而 B3+一半分布于四面体空隙另一半分布
于八面体空隙,通式为 B(AB)O4,称为反尖晶石。
(f)任何晶体都对应一种布拉菲格子,因此任何晶体都可划分出与此种布拉菲
格子平行六面体相对应的部分,这一部分晶体就称为晶胞。晶胞是能够反映晶体
湖南工学院
材料物理化学
结构特征的最小单位。 表示晶体结构特征的参数(a、b、c,α(bc)∧、β(ac)∧、
γ(ab)∧)称为晶胞常数,晶胞参数也即晶体常数。
(g):配位数:晶体结构中与一个离子直接相邻的异号离子数。配位体:晶体
结构中与某一个阳离子直接相邻、形成配位关系的各个阴离子中心连线所构成的
多面体。
(h)同质多晶:同一化学组成在不同外界条件下(温度、压力、pH值等),结
晶成为两种以上不同结构晶体的现象。多晶转变:当外界条件改变到一定程度时,
各种变体之间发生结构转变,从一种变体转变成为另一种变体的现象。
(i)位移性转变:不打开任何键,也不改变原子最邻近的配位数,仅仅使结构
发生畸变,原子从原来位置发生少许位移,使次级配位有所改变的一种多晶转变
形式。重建性转变:破坏原有原子间化学
键,改变原子最邻近配位数,使晶体结构完全改变原样的一种多晶转变形式。
(j)晶体场理论:认为在晶体结构中,中心阳离子与配位体之间是离子键,不
存在电子轨道的重迭,并将配位体作为点电荷来处理的理论。配位场理论:除了
考虑到由配位体所引起的纯静电效应以外,还考虑了共价成键的效应的理论。
2、在氧离子面心立方密堆积结构中,对于获得稳定结构各需何种价离子,其中:
(1)所有八面体间隙位置均填满;
(2)所有四面体间隙位置均填满;
(3)填满一半八面体间隙位置;
(4)填满一半四面体间隙位置。
并对每一种堆积方式举一晶体实例说明之。
解:(1)填满所有的八面体空隙,2价阳离子,MgO;
(2)填满所有的四面体空隙,1价阳离子,Li
2
O;
(3)填满一半的八面体空隙,4价阳离子,TiO
2
;
(4)填满一半的四面体空隙,2价阳离子,ZnO。
3、试解释:
(a)在AX型晶体结构中,NaCl型结构最多;
湖南工学院
材料物理化学
(b)MgAl
2
O
4
晶体结构中,按r
+
/r
-
与CN关系,Mg
2+
、A
l3+
都填充八面体空隙,但
在该结构中Mg
2+
进入四面体空隙,Al
3+
填充八面体空隙;而在MgFe
2
O
4
结构中,
Mg
2+
填充八面体空隙,而一半Fe
3+
填充四面体空隙。
(c)绿宝石和透辉石中Si:O都为1:3,前者为环状结构,后者为链状结构。
解:(a)在AX型晶体结构中,一般阴离子X的半径较大,而阳离子A的半
径较小,所以X做紧密堆积,A填充在其空隙中。大多数AX型化合物的r
+
/r
-
在
0.414~0.732之间,应该填充在八面体空隙,即具有NaCl型结构;并且NaCl型晶
体结构的对称性较高,所以AX型化合物大多具有NaCl型结构。
(b)按照阳、阴离子半径比与配位数之间的关系,Al
3+
与Mg
2+
的配位数均应该
为6,填入八面体空隙。但是,根据鲍林规则,高电价离子填充于低配位的四面
体空隙时,排斥力要比填充八面体空隙中较大,稳定性较差,所以Al
3+
填入八面
体空隙,而Mg
2+
填入四面体空隙。
而在MgFe
2
O
4
结构中,由于Fe
3+
的八面体择位能为0,可以进入四面体或八面体空
隙,当配位数为4时,Fe
3+
离子半径0.049nm,Mg
2+
离子半径0.057nm,Fe
3+
在四面
体空隙中更加稳定,所以Mg
2+
填充八面体空隙、一半Fe
3+
填充四面体空隙。
(c)绿宝石和透辉石中Si:O都为1:3。但是,绿宝石中的其它阳离子Be
2+
和Al
3+
的离子半径较小,配位数较小(4或6),相互间斥力较大,所以绿宝石通过[SiO
4
]
顶角相连形成六节环,再通过Be
2+
和Al
3+
将六节环连接起来,离子堆积结合状态
不太紧密,这样晶体结构较稳定。透辉石中是Mg
2+
和Ca
2+
,离子半径较大,配位
数较大(分别为6和8),相互间斥力较小,所以透辉石通过[SiO
4
]顶角相连形成
单链,离子堆积结合状态比较紧密。
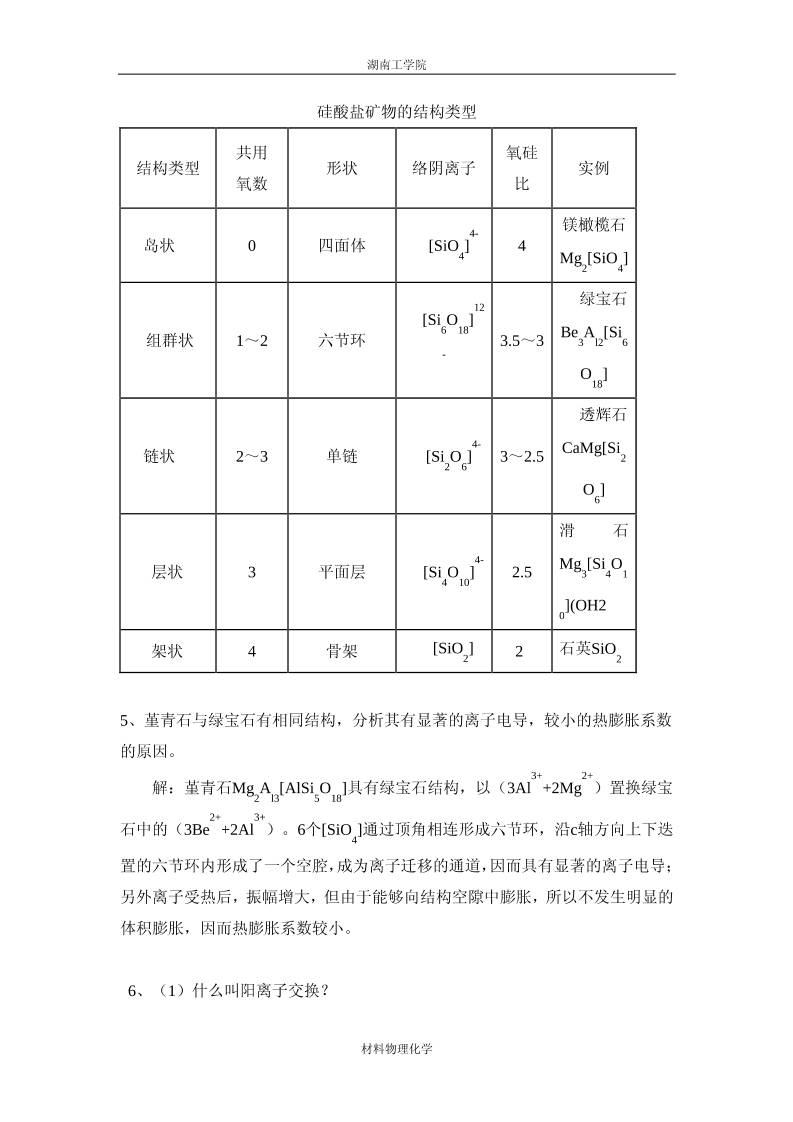
4、叙述硅酸盐晶体结构分类原则及各种类型的特点,并举一例说明之。
解:硅酸盐矿物按照硅氧四面体的连接方式进行分类,具体类型见下表。
湖南工学院
材料物理化学
硅酸盐矿物的结构类型
结构类型
共用
氧数
形状 络阴离子
氧硅
比
实例
岛状 0 四面体 [SiO
4
]
4-
4
镁橄榄石
Mg
2
[SiO
4
]
组群状 1~2 六节环
[Si
6
O
18
]
12
-
3.5~3
绿宝石
Be
3
A
l2
[Si
6
O
18
]
链状 2~3 单链 [Si
2
O
6
]
4-
3~2.5
透辉石
CaMg[Si
2
O
6
]
层状 3 平面层 [Si
4
O
10
]
4-
2.5
滑 石
Mg
3
[Si
4
O
1
0
](OH2
架状 4 骨架 [SiO
2
] 2 石英SiO
2
5、堇青石与绿宝石有相同结构,分析其有显著的离子电导,较小的热膨胀系数
的原因。
解:堇青石Mg
2
A
l3
[AlSi
5
O
18
]具有绿宝石结构,以(3Al
3+
+2Mg
2+
)置换绿宝
石中的(3Be
2+
+2Al
3+
)。6个[SiO
4
]通过顶角相连形成六节环,沿c轴方向上下迭
置的六节环内形成了一个空腔,成为离子迁移的通道,因而具有显著的离子电导;
另外离子受热后,振幅增大,但由于能够向结构空隙中膨胀,所以不发生明显的
体积膨胀,因而热膨胀系数较小。
6、(1)什么叫阳离子交换?
湖南工学院
材料物理化学
(2)从结构上说明高岭石、蒙脱石阳离子交换容量差异的原因。
解:(1)在粘土矿物中,如果入层间,来平衡多余的负电荷,在一定条件
下这些阳离子可[AlO
6
]层中部分Al
3+
被Mg
2+
、Fe
2+
代替时,一些水化阳离子(如
Na
+
、Ca
2+
等)进以被其它阳离子交换,这种现象称为阳离子交换。
(2)高岭石的阳离子交换容量较小,而蒙脱石的阳离子交换容量较大。因为高
岭石是1:1型结构,单网层与单网层之间以氢键相连,氢键强于范氏键,水化阳
离子不易进入层间,因此阳离子交换容量较小。而蒙脱石是为2:1型结构,复网
层间以范氏键相连,层间联系较弱,水化阳离子容易进入复网层间以平衡多余的
负电荷,因此蒙脱石的阳离子交换容量较大。
7、同为碱土金属阳离子 Be
2+
、Mg
2+
、Ca
2+
,其卤化物 BeF
2
和 SiO
2
结构同,MgF
2
与 TiO
2
(金红石型)结构同,CaF
2
则有萤石型结构,分析其原因。
解:碱土金属离子Be
2+
、Mg
2+
、Ca
2+
,随着原子序数的增大,离子半径逐渐
增大,极化性能变化不大。当阴离子同为F
-
时,使得其r+/r-增大,配位数增大,
由BeF
2
的4配位到MgF
2
的6配位,再到CaF
2
的8配位。
8、金刚石结构中C原子按面心立方排列,为什么其堆积系数仅为34%?
解:为了分析晶体结构方便起见,金刚石结构中C原子可以看成按面心立方
排列。但实际上由于C原子之间是共价键,具有方向性和饱和性,每个C原子只
与4个C原子形成价键(紧密相邻),所以并没有达到紧密堆积(紧密堆积时每
个原子同时与12个原子紧密相邻),其晶体结构内部存在很多空隙。所以其堆积
系数仅为34%,远远小于紧密堆积的74.05%。
9、简答题
(1)试述玻璃和晶体的差别?
(2)晶胞与空间格子是何种关系?
解:(1)晶体的内部质点在三维空间作有规律的重复排列,兼具短程有序
湖南工学院
材料物理化学
和长程有序的结构。而玻璃的内部质点则呈近程有序而远程无序的无规网络结构
或微晶子结构。与非晶体比较晶体具有自限性、均一性、异向性、对称性、最小
内能和稳定性。
(2)晶胞是指能够充分反映整个晶体结构特征的最小结构单位,晶体可看成晶
胞的无间隙堆垛而成。晶胞的形状大小与对应的单位平行六面体完全一致,并可
用与平行六面体相同的参数来表征晶胞的几何特征。其区别是单位平行六面体是
不具任何物理、化学特征的几何点(等同点)构成的。而晶胞则是实在的具体质
点构成。
10、以NaCl晶胞为例,试说明面心立方紧密堆积中的八面体和四面体空隙的位
置和数量。
解:以NaCl晶胞中(001)面心的一个球(Cl离子)为例,它的正下方有1
个八面体空隙(体心位置),与其对称,正上方也有1个八面体空隙;前后左右
各有1个八面体空隙(棱心位置)。所以共有6个八面体空隙与其直接相邻,由于
每个八面体空隙由6个球构成,所以属于这个球的八面体空隙数为6×1/6=1。
在这个晶胞中,这个球还与另外 2个面心、1个顶角上的球构成 4个四面体空隙
(即 1/8小立方体的体心位置);由于对称性,在上面的晶胞中,也有 4个四面
体空隙由这个参与构成。所以共有 8个四面体空隙与其直接相邻,由于每个四面
体空隙由 4个球构成,所以属于这个球的四面体空隙数为 8×1/4=2。
11、Li2O晶体,Li
+的半径为 0.074nm,O2
-的半径为 0.140nm,其密度为 1.646g/cm3,
求晶胞常数 a0;晶胞中 Li2O的分子数。
解:按照已知密度计算:
根据已知离子半径计算:[LiO4]的棱为小立方体的面对角线。
湖南工学院
材料物理化学
将已知数值代入上式并解方程得:
12、在透辉石 CaMg[Si2O6]晶体结构中,O
2-与阳离子 Ca
2+、Mg
2+、Si
4+配位型式
有哪几种,符合鲍林静电价规则吗?为什么?
解:透辉石 CaMg[Si2O6],O
2-与阳离子 Ca
2+、Mg
2+、Si
4+配位型式有三种,
即 2个桥氧和 2个非桥氧形成[SiO4],6个非桥氧形成[MgO6],4个桥氧和 4个
非桥氧形成[CaO8]。同时与 1个 Si
4+、2个Mg
2+和 1个 Ca
2+配位的非桥氧,其静
电价强度总和为 4×1/4+2×2×1/6+2×1/8=23/12,而同时与 1个 Si
4+、1个Mg
2+和 1
个 Ca
2+配位的非桥氧,其静电价强度总和为 4×1/4+2×1/6+2×1/8=19/12,小于其
负电价;同时与 2个 Si
4+、2个 Ca
2+配位的桥氧,其静电价强度总和为
4×2×1/4+2×2×1/8=5/2,大于其负电价。所以不完全符合鲍林静电价规则。但是
其总体电价仍然平衡的,晶体结构仍然是稳定的。
原因在于Mg
2+和 Ca
2+两种离子的离子半径不同、配位数不同、配位氧离子不同
(桥氧或非桥氧)。
13 面排列密度的定义为:在平面上球体所占的面积分数。
(a)画出MgO(NaCl型)晶体(111)、(110)和(100)晶面上的原子排布
图;
(b)计算这三个晶面的面排列密度。
解:MgO晶体中 O2-做紧密堆积,Mg2+填充在八面体空隙中。
(a)(111)、(110)和(100)晶面上的氧离子排布情况如图 2-1所示。
湖南工学院
材料物理化学
图 2-1 MgO晶体中不同晶面的氧离子排布示意图
(b)在面心立方紧密堆积的单位晶胞中,
(111)面:面排列密度=
(110)面:面排列密度=
(100)面:面排列密度=
14、试证明等径球体六方紧密堆积的六方晶胞的轴比 c/a≈1.633。
证明:六方紧密堆积的晶胞中,a轴上两个球直接相邻,a0=2r;c轴方向上,中
间的一个球分别与上、下
各三个球紧密接触,形成四面体,如图
2-2所示:
图 2-2 六方紧密堆积晶胞中 有关尺寸
关系示意图
15、设原子半径为 R,试计算体心立方堆积结构的(100)、(110)、(111)
面的面排列密度和晶面族的面间距。
解:在体心立方堆积结构中:
(100)面:面排列密度=
面间距=
湖南工学院
材料物理化学
(110)面:面排列密度=
面间距=
(111)面:面排列密度=
面间距=
16、以 NaCl晶胞为例,试说明面心立方紧密堆积中的八面体和四面体空隙的位
置和数量。
答:以 NaCl晶胞中(001)面心的一个球(Cl-离子)为例,它的正下方有 1个
八面体空隙(体心位置),与其对称,正上方也有 1个八面体空隙;前后左右各
有 1个八面体空隙(棱心位置)。所以共有 6个八面体空隙与其直接相邻,由于
每个八面体空隙由 6个球构成,所以属于这个球的八面体空隙数为 6×1/6=1。
在这个晶胞中,这个球还与另外 2个面心、1个顶角上的球构成 4个四面体空隙
(即 1/8小立方体的体心位置);由于对称性,在上面的晶胞中,也有 4个四面
体空隙由这个参与构成。所以共有 8个四面体空隙与其直接相邻,由于每个四面
体空隙由 4个球构成,所以属于这个球的四面体空隙数为 8×1/4=2。
17、 临界半径比的定义是:紧密堆积的阴离子恰好互相接触,并与中心的阳离
子也恰好接触的条件下,阳离子半径与阴离子半径之比。即每种配位体的阳、阴
离子半径比的下限。计算下列配位的临界半径比:(a)立方体配位;(b)八面
体配位;(c)四面体配位;(d)三角形配位。
解:(1)立方体配位
在立方体的对角线上正、负离子相互接触,在立方体的棱上两个负离子相互接触。
因此:
(2)八面体配位
在八面体中,中心对称的一对阴离子中心连线上正、负离子相互接触,棱上两个
湖南工学院
材料物理化学
负离子相互接触。因此:
(3)四面体配位
在四面体中中心正离子与四个负离子直接接触,四个负离子之间相互接触(中心
角 )。因此:
底面上对角中心线长为:
(4)三角体配位
在三角体中,在同一个平面上中心正离子与三个负离子直接接触,三个负离子之
间相互接触。因此:
18、 一个面心立方紧密堆积的金属晶体,其原子量为M,密度是 8.94g/cm3。
试计算其晶格常数和原子间距。
解:根据密度定义,晶格常数
原子间距=
19、试根据原子半径 R计算面心立方晶胞、六方晶胞、体心立方晶胞的体积。
解:面心立方晶胞:
湖南工学院
材料物理化学
六方晶胞(1/3):
体心立方晶胞:
20、MgO具有 NaCl结构。根据 O
2-半径为 0.140nm和Mg
2+半径为 0.072nm,计
算球状离子所占据的体积分数和计算MgO的密度。并说明为什么其体积分数小
于 74.05%?
解:在MgO晶体中,正负离子直接相邻,a0=2(r++r-)=0.424(nm)
体积分数=4×(4π/3)×(0.143+0.0723)/0.4243=68.52%
密度=4×(24.3+16)/[6.023×1023×(0.424×10-7)3]=3.5112(g/cm3)
MgO体积分数小于 74.05%,原因在于 r+/r-=0.072/0.14=0.4235>0.414,正负离子
紧密接触,而负离子之间不直接接触,即正离子将负离子形成的八面体空隙撑开
了,负离子不再是紧密堆积,所以其体积分数小于等径球体紧密堆积的体积分数
74.05%。
21、半径为 R的球,相互接触排列成体心立方结构,试计算能填入其空隙中的
最大小球半径 r。体心立方结构晶胞中最大的空隙的坐标为(0,1/2,1/4)。
解:在体心立方结构中,同样存在八面体和四面体空隙,但是其形状、大小
和位置与面心立方紧密堆积略有不同。
湖南工学院
材料物理化学
设:大球半径为 R,小球半径为 r。则位于立方体面心、棱心位置的八面体空隙
能够填充的最大的小球尺寸为:
位于立方体(0.5,0.25,0)位置的四面体空隙能够填充的最大的小球尺寸为:缩略图:
当前页面二维码






 工程招标采购
工程招标采购 搞笑表情
搞笑表情 微信头像
微信头像 美女图片
美女图片 APP小游戏
APP小游戏 PPT模板
PPT模板