材料电化学复习提纲+version1.0.pdf
- 文件大小: 770.65KB
- 文件类型: pdf
- 上传日期: 2025-08-23
- 下载次数: 0
概要信息:
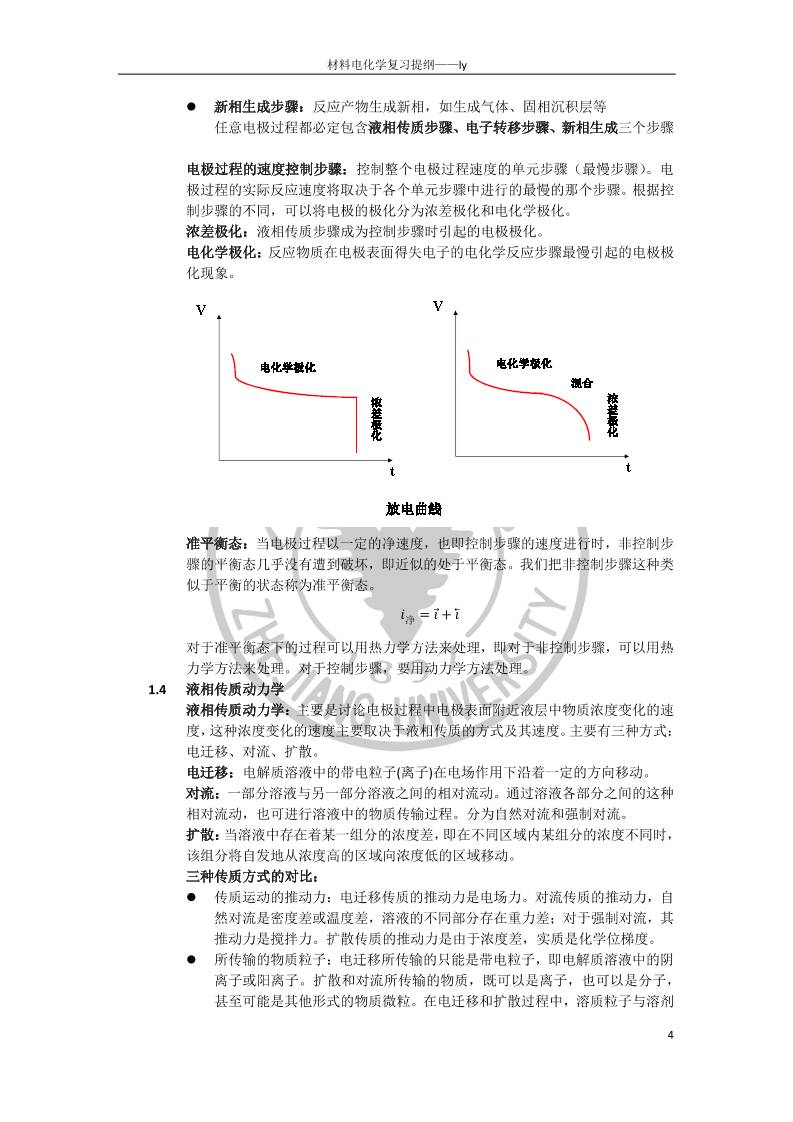
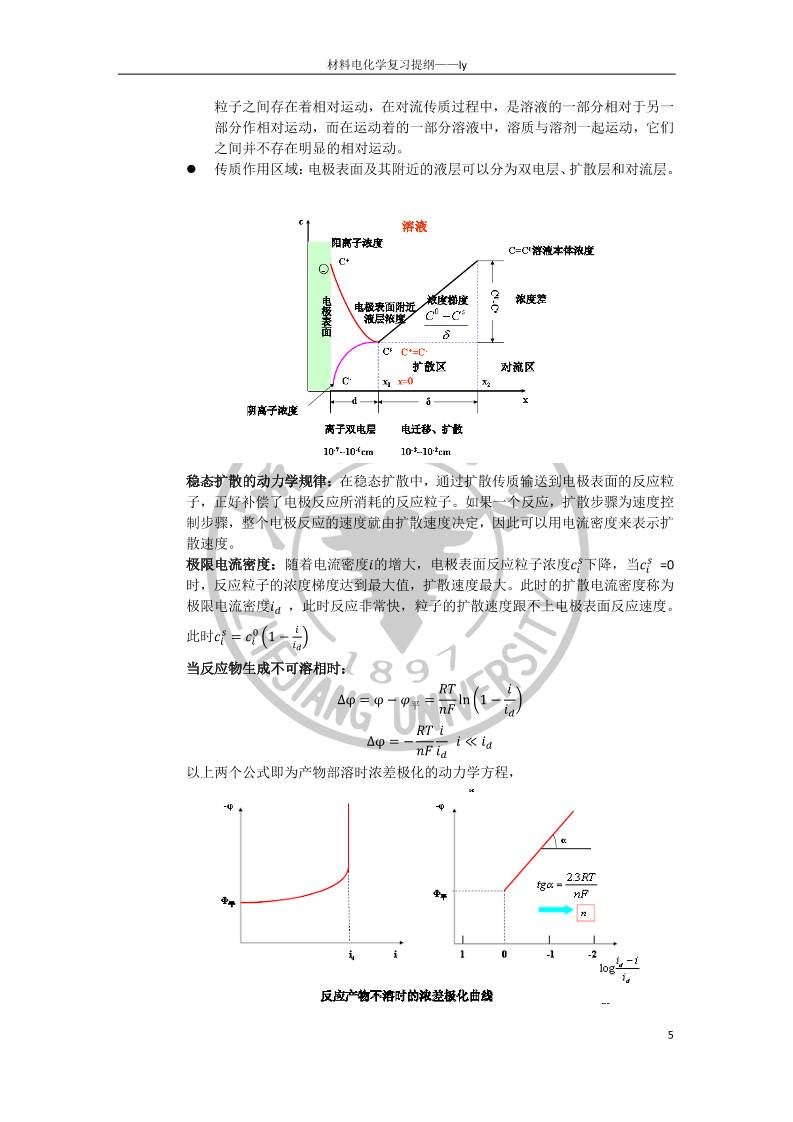
材料电化学复习提纲 一、 电化学基本理论 1. 电化学热力学 1.1 相间电位和电极电位 相间电位:两相接触时,在两相界面层存在的电位差。两相之间出现电位差的原因 是带电粒子或者电偶极子在界面层中的非均匀分布。离子双电层是相间电位的主要 来源。 离子双电层:带电粒子在两相间的转移或利用外电源向界面两侧充电,都可以使两 相中出现剩余点和,这些剩余电荷不同程度地集中在界面两侧,形成双电层。 第一类导体:载流子是电子 第二类导体:载流子是离子 电化学位: 𝜇𝑖 = 𝜇𝑖 + 𝑛𝐹(𝜓 + 𝜒) 𝜙 = 𝜓 + 𝜒 𝜙是绝对电位,也称为内电位;𝜓称为外电位;𝜒称为表面电位;𝜇𝑖为化学势;电化 学位𝜇𝑖不但与粒子及 M 相物质的化学本性有关,也决定于 M 相所带的电荷数量和 分布情况。 电极体系:在相互接触的两个导体相中,一个是电子导电相,另一个是离子导电相, 并且在相界面上有电荷转移,这个体系就称为电极体系,简称为电极。 电极电位:电极体系中,两类导体界面所形成的相间电位,即电极材料和离子导体 的内电位差称为电极电位。电极电位主要决定于离子双电层的形成。 绝对电位:电子导电相和离子导电相之间的内电位差,其数值称为电极的绝对电位。 但是其值无法直接测量出来。 参比电极:能作为基准的、其电极电位保持恒定的电极 相对电位: 将参比电极与被测电极组成一个原电池回路,所测出的电池端电压 E, 即为该被测电极的相对电位。 1.2 电化学体系 电化学体系:由两类不同导体组成的,在电荷转移时不可避免的伴随着物质变化的 体系。根据电化学反应条件和结果的不同,可以分为以下三种电化学体系 原电池:将两个电极与外电路负载接通后,能够自发地将电流送到外电路做功。(化 学能→ 电能); 基本特征是通过电池反应将化学能转化为电能,(区别于普通的氧化还原反应)。 电池的可逆性:电池进行可逆性变化,必须要具备以下两个条件 电池中的化学变化是可逆的,即物质的变化是可逆的。也就是说电池在 工作过程中所发生的物质变化,在通以反向电流时,有重新恢复原状的可 能。 电池中能量的转化是可逆的。也就是说电能或者化学能不转变为热能散失, 用电池放电时放出的的能量在对电池充电,电池体系和环境都能恢复到原 来状态。 原电池电动势:电池中没有电流通过时,原电池两个终端相之间的电位差叫做 电池电动势,用 E 表示。E=-ΔG/nF,即原电池的电能来源于电池反应引起的自 由能变化。但是上式只适用于可逆电池。 原电池温度系数:恒压下原电池电动势对温度的偏导数称为原电池电动势的温 材料电化学复习提纲——ly 2 度系数( 𝜕𝐸 𝜕𝑇 ) 𝑝 ,而ΔS = nF ( 𝜕𝐸 𝜕𝑇 ) 𝑝 。 电动势的热力学计算:能斯特方程反映了可逆状态下的电池电动势计算 𝐸 = 𝐸𝑂 − 𝑅𝑇 𝑛𝐹 𝑙𝑛 ∏ 𝑎 生成物 𝜐‘ ∏ 𝑎 反应物 𝜐 电解池:与外电源组成回路,强迫电流在电化学体系中通过并促使电化学反应发生。 (电能→ 化学能) 腐蚀电池:电化学反应能够自发进行,但不对外做功,只起到破坏金属的作用。(短 路的原电池) 1.3 平衡电极电位及不可逆电极 电极的可逆性:要使得整个电池可逆,则两个电极必须是可逆的。可逆电极必须具 备以下两个条件 电极反应是可逆的:只有正、逆反应速度相等时,电极反应中的物质交换和 电荷交换才是平衡的,这样的电极反应才称为可逆的电极反应。 电极在平衡条件下工作:通过电极的电流等于 0 或者无限小,只有在这个条 件下,电极上进行的氧化还原反应速度才能被认为是相等的。 可逆电极的电位:用能斯特电极电位公式描述 𝜑平 = 𝜑0 + 𝑅𝑇 𝑛𝐹 𝑙𝑛 𝑎𝑂 𝑎𝑅 不可逆电极:实际的电化学体系中很多电极并不满足可逆电极条件,这类电极叫做 不可逆电极;基本特征是电极电位的数值不能用能斯特电极电位公式来描述 影响电极电位的因素:影响电极电位的因素包括了金属的性质和外围介质的性质两 方面,主要有以下几个因素: 电极的本性:电极的组成。氧化态、还原态物质不同,得失电子能力不同, 电极电位不同。 金属的表面状态:金属表面加工精度,表面层纯度,氧化膜,原子、分子在 表面的吸附等等,影响范围在 1V 左右。氧化膜可使金属电极电位正移,主 要是金属离子溶解困难 金属的机械变形和内应力:变形和内应力的存在通常使电极电位变负。金属 离子能量增高,活性增大,容易溶解。 溶液的 pH 值:影响可达数百毫伏。 溶液中氧化剂的存在:氧化剂通常使电极电位变正,吸附氧或保护膜。 溶液中络合剂的存在:一般,络合剂的存在使电极电位变负,主要是金属离 子不再以水化离子存在,而是以络合离子存在。 溶剂的影响:主要与离子的溶剂化能力有关。 2. 电极过程动力学 1.1 电极的极化 电极的极化:有电流通过时电极电位偏离平衡电位的现象叫做电极的极化。,发 生电极极化时,阴极的电极电位总是变得比平衡电位更负,阳极的电极电位总是 变得比平衡电位更正。 过电位:一定的电流密度下,电极电位与平衡电位的差值称为该电流密度下的过 材料电化学复习提纲——ly 3 电位。即 𝜂 = 𝜑 − 𝜑平 过电位随着电极的电流密度不同而不同,电流密度越大,过电位绝对值也越大。 电极极化的原因:电极极化的实质是电极反应速度跟不上电子运动速度,从而造 成电荷在界面上的积累。有电流通过时,阴极上,由于电子流入电极的速度大, 造成负电荷的积累;阳极上,由于电子流出电极的速度大,造成正电荷积累。因 此,阴极电位向负移动,阳极电位向正移动。 理想极化电极:在一定条件下电极上不发生电极反应的电极。通电时不存在去极 化作用,流入电极的电荷全部在电极表面积累,只起到改变电极电位的作用,即 改变双电层的结构。 理想不极化电极:电极反应速度很大,去极化与极化作用接近平衡,有电流通过 时电极电位几乎不变化,即电极不出现极化现象。 极化曲线:过电位或电极电位随电流密度的关系曲线,是表征电极极化性能的重 要数据。稳态时的极化曲线反映了电极反应速度与电极电位(或过电位)之间的特 征关系。 1.2 原电池及电解池的极化 原电池的极化:原电池极化导致电位差减小 V = E − 𝜂+ − 𝜂− − I ∙ R 电解池的极化:电解池极化导致端电压增大 V = E + 𝜂+ + 𝜂− + I ∙ R 超电压:两个电极过电位之和 1.3 电极过程的基本历程、速度控制步骤以及电极过程的基本处理办法 电极过程的基本历程:有以下五个基本历程: 液相传质步骤:反应粒子向电极表面附近液层迁移 前置转化:反应粒子在电极表面或电极表面负极液层进行电化学反应前的某 种转化过程 电子转移步骤:反应粒子在电极/溶液界面上得到或是去电子,生成还原反 应或氧化反应产物 随后转化:反应产物在电极表面或表面附近液层中进行电化学反应后的转化, 如反应产物的脱附、复合、分解等 材料电化学复习提纲——ly 4 新相生成步骤:反应产物生成新相,如生成气体、固相沉积层等 任意电极过程都必定包含液相传质步骤、电子转移步骤、新相生成三个步骤 电极过程的速度控制步骤:控制整个电极过程速度的单元步骤(最慢步骤)。电 极过程的实际反应速度将取决于各个单元步骤中进行的最慢的那个步骤。根据控 制步骤的不同,可以将电极的极化分为浓差极化和电化学极化。 浓差极化:液相传质步骤成为控制步骤时引起的电极极化。 电化学极化:反应物质在电极表面得失电子的电化学反应步骤最慢引起的电极极 化现象。 准平衡态:当电极过程以一定的净速度,也即控制步骤的速度进行时,非控制步 骤的平衡态几乎没有遭到破坏,即近似的处于平衡态。我们把非控制步骤这种类 似于平衡的状态称为准平衡态。 𝑖净 = 𝑖 + ?⃖? 对于准平衡态下的过程可以用热力学方法来处理,即对于非控制步骤,可以用热 力学方法来处理。对于控制步骤,要用动力学方法处理。 1.4 液相传质动力学 液相传质动力学:主要是讨论电极过程中电极表面附近液层中物质浓度变化的速 度,这种浓度变化的速度主要取决于液相传质的方式及其速度。主要有三种方式: 电迁移、对流、扩散。 电迁移:电解质溶液中的带电粒子(离子)在电场作用下沿着一定的方向移动。 对流:一部分溶液与另一部分溶液之间的相对流动。通过溶液各部分之间的这种 相对流动,也可进行溶液中的物质传输过程。分为自然对流和强制对流。 扩散:当溶液中存在着某一组分的浓度差,即在不同区域内某组分的浓度不同时, 该组分将自发地从浓度高的区域向浓度低的区域移动。 三种传质方式的对比: 传质运动的推动力:电迁移传质的推动力是电场力。对流传质的推动力,自 然对流是密度差或温度差,溶液的不同部分存在重力差;对于强制对流,其 推动力是搅拌力。扩散传质的推动力是由于浓度差,实质是化学位梯度。 所传输的物质粒子:电迁移所传输的只能是带电粒子,即电解质溶液中的阴 离子或阳离子。扩散和对流所传输的物质,既可以是离子,也可以是分子, 甚至可能是其他形式的物质微粒。在电迁移和扩散过程中,溶质粒子与溶剂 材料电化学复习提纲——ly 5 粒子之间存在着相对运动,在对流传质过程中,是溶液的一部分相对于另一 部分作相对运动,而在运动着的一部分溶液中,溶质与溶剂一起运动,它们 之间并不存在明显的相对运动。 传质作用区域:电极表面及其附近的液层可以分为双电层、扩散层和对流层。 稳态扩散的动力学规律:在稳态扩散中,通过扩散传质输送到电极表面的反应粒 子,正好补偿了电极反应所消耗的反应粒子。如果一个反应,扩散步骤为速度控 制步骤,整个电极反应的速度就由扩散速度决定,因此可以用电流密度来表示扩 散速度。 极限电流密度:随着电流密度𝑖的增大,电极表面反应粒子浓度𝑐𝑖 𝑠下降,当𝑐𝑖 𝑠 =0 时,反应粒子的浓度梯度达到最大值,扩散速度最大。此时的扩散电流密度称为 极限电流密度𝑖𝑑 ,此时反应非常快,粒子的扩散速度跟不上电极表面反应速度。 此时𝑐𝑖 𝑠 = 𝑐𝑖 0 (1 − 𝑖 𝑖𝑑 ) 当反应物生成不可溶相时: Δφ = φ − 𝜑平 = 𝑅𝑇 𝑛𝐹 ln (1 − 𝑖 𝑖𝑑 ) Δφ = − 𝑅𝑇 𝑛𝐹 𝑖 𝑖𝑑 𝑖 ≪ 𝑖𝑑 以上两个公式即为产物部溶时浓差极化的动力学方程, 材料电化学复习提纲——ly 6 当反应产物可溶时,浓差极化比较复杂。定义半波电位为𝜑1 2 ,当𝑖 = 1 2 𝑖𝑑时 𝜑1 2 = 𝜑0 + 𝑅𝑇 𝑛𝐹 𝑙𝑛 𝑟𝑂𝛿𝑂𝐷𝑅 𝑟𝑅𝛿𝑅𝐷𝑂 则浓差极化动力学方程为 φ = 𝜑1 2 + 𝑅𝑇 𝑛𝐹 𝑙𝑛 𝑖𝑑 − 𝑖 𝑖 浓差极化的特征: id 的出现:当电极过程受扩散步骤控制时,在一定的电极电位范围内,出现 一个不受电极电位变化影响的极限电流密度 id 极化曲线斜率关系:浓差极化曲线φ对 log(1-i/id)或 log(id/i-1)作图,可以得到 直线关系,直线斜率为 2.3RT/nF 搅拌的影响:电流密度 i 和极限电流密度 id 随溶液搅拌强度的增大而增大。 搅拌导致溶液流动速度增大,扩散速度增大,扩散层厚度减薄,从而导致 i 和 id 增大 扩散电流密度与电极表面的真实面积(电极材料颗粒表面积之和)无关,而与 电极表面的表观面积有关。这是因为 i 取决于扩散流量,扩散流量的大小与 扩散流量所通过的截面积(即电极表观面积)有关,而与电极表面的真实面积 无关。 1.5 电子转移步骤的动力学 电子转移步骤:反应物质在电极/溶液界面得到电子或失去电子,从而还原或氧 化成新物质的过程。这一过程包含化学反应和电荷传递两个内容。电极过程最重 要的特征就是电极电位对电极反应速度的影响。这种影响可以是直接的,也可以 是间接的。 电极电位对电极反应速度的影响: 当电子转移步骤是非控制步骤时,电化学反应本身的平衡状态基本未遭到破 坏,电极电位所发生的变化通过改变某些参与控制步骤的粒子的表面浓度间 接地影响电极反应速度。这种方式也称为热力学方式 当电子转移步骤是控制步骤时,电极电位的变化将直接影响电子转移步骤和 整个电极反应过程的速度。这种情况称为电极电位按“动力学方式”影响电 极反应速度。电极电位对电子转移步骤的直接影响是通过对该步骤活化能的 影响而实现的。 电极电位与反应活化能之间的关系通式 材料电化学复习提纲——ly 7 𝛥?⃗? = 𝛥𝐺0⃗⃗ ⃗⃗ ⃗ + 𝛼𝐹𝛥𝜙 还原反应 𝛥?⃖? = 𝛥𝐺0⃖⃗ ⃗⃗ ⃗ − 𝛽𝐹𝛥𝜙 氧化反应 其中α、β称为传递系数或者对称系数,表示电极电位对还原反应活化 能和氧化反应活化能影响的程度,对单电子过程 α + β = 1 对多电子过程 α + β ≠ 1 反应速度与反应活化能的关系 根据阿伦尼乌斯关系式 𝑣 = 𝑘𝑐𝑒𝑥𝑝 (− 𝛥𝐺 𝑅𝑇 ) 可以得到反应速度与电极电位的关系式 还原反应 𝑗 = 𝐹?⃗⃗?𝑐𝑂𝑒𝑥𝑝 (− 𝛼𝐹𝜑平 𝑅𝑇 ) 氧化反应 𝑗 = 𝐹?⃗⃖?𝑐𝑅𝑒𝑥𝑝 ( 𝛽𝐹𝜑平 𝑅𝑇 ) 动力学参数 传递系数 α、β称为传递系数或者对称系数,表示电极电位对还原反应活化能和氧化 反应活化能影响的程度,对单电子过程 α + β = 1 对多电子过程 α + β ≠ 1 交换电流密度 平衡电位下的还原反应速度与氧化反应速度相等,可以用一个统一的符号表 示这两个反应的速度 𝑗0 = 𝐹?⃗⃗?𝑐𝑂𝑒𝑥𝑝 (− 𝛼𝐹𝜑平 𝑅𝑇 ) = 𝐹?⃗⃖?𝑐𝑅𝑒𝑥𝑝 ( 𝛽𝐹𝜑平 𝑅𝑇 ) 我们把𝑗0叫做该电极反应的交换电流密度。它表示平衡电位下氧化反应和还 原反应的绝对速度。交换电流密度本身表征了电极反应在平衡状态下的动力 材料电化学复习提纲——ly 8 学特征。 交换电流密度与与反应速度常数有关、与电极材料有关、与反应物质浓度有 关。 净电极反应速度: 𝐣 = 𝒋 + 𝒋 𝒋净 = 𝒋𝟎 (𝑒𝑥𝑝 (− 𝛼𝐹Δ𝜑 𝑅𝑇 ) − 𝑒𝑥𝑝 ( 𝛽𝐹Δ𝜑 𝑅𝑇 )) 不同电极反应若要以同一个净反应速度进行,那么交换电流密度越大者,所 需要的极化值越小,电极的可逆性好。交换电流密度小的电极反应,则表现 出较小的可逆性,电极容易极化。 出现净反应 电极反应速度常数 ?⃗⃗? = ?⃗⃗?𝑒𝑥𝑝 (− Δ𝐺𝑂⃗⃗ ⃗⃗ ⃗⃗ 𝑅𝑇 ) ?⃗⃖? = ?⃖⃗?𝑒𝑥𝑝 (− Δ𝐺𝑂⃖⃗ ⃗⃗ ⃗⃗ 𝑅𝑇 ) 表示电位坐标零点处,即𝜙 = 0处还原/氧化反应的反应速度常数 稳态电化学极化规律 稳态电化学极化时,外电流密度等于电子转移步骤净反应速度。 𝒋 = 𝒋𝟎 (𝑒𝑥𝑝 (− 𝛼𝐹𝛥𝜑 𝑅𝑇 ) − 𝑒𝑥𝑝 ( 𝛽𝐹𝛥𝜑 𝑅𝑇 )) 出现净反应的必要条件是剩余界面电场的存在,即过电位的存在。过电位是电极 反应发生的推动力,电极极化时过电位的大小取决于外电流密度和交换电流密度 的相对大小。外电流密度一定,交换电流密度大,过电位小。 高过电位下的电化学极化规律 当过电位比较高时,满足 Tafel 极化,Butler-Volmer 方程的两个指数项相差 100 倍以上。25°C 时过电位𝜂𝑐 > 0.116𝑉 材料电化学复习提纲——ly 9 低过电位下的电化学极化规律 混合控制时的电化学极化规律 当𝑖𝑐 ≪ 𝑖0 𝑖𝑐 ≪ 𝑖𝑑 ,时, 电极不发生极化,接近平衡电极电位 当𝑖0 ≪ 𝑖𝑐 ≪ 𝑖𝑑时,电极过程过程受电子转移步骤控制 当𝑖𝑐 ≈ 𝑖𝑑 ≪ 𝑖0时,电极过程的控制步骤是浓度控制 当𝑖𝑐 ≈ 𝑖𝑑 ≫ 𝑖0时,两项均不能忽略,过电位受电化学极化和弄差极化共同控制 电化学极化规律与浓差极化规律的比较 材料电化学复习提纲——ly 10 二、 电化学测试方法 1. 电化学实验的基础知识 1.1 电化学测试的主要任务:通过测试包含电极过程动力学信息的电压、电流两个物 理量,研究它们在各种极化信号激励下的变化关系,从而研究电极过程的各个基 本过程。 1.2 电化学测试的主要步骤 1.3 电极电位的测量:绝对电位不可测量,测量的都是相对电位 1.4 极化条件下的电位测量:电极极化时辅助电极会发生极化,不能作为电位比较的 标准;极化电流在研究电极和辅助电极之间溶液上引起的欧姆降也将附加到被测 的电极电位中,造成测量误差。可以引入三电极体系 工作电极:研究电极或实验电极。该电极上所发生的电极过程即为研究对象, 因此要求其具有重现的表面性质。一般是固体金属电极、液体金属电极或碳 电极。 辅助电极:研究阴极过程时,辅助电极作阳极;研究阳极过程,辅助电极作 阴极。辅助电极的面积一般比研究电极大,可以降低其电流密度,使其在测 量过程中基本上不被极化。常用铂黑电极作辅助电极。辅助电极设计过量 参比电极:是测量电极电势的比较标准,在测量过程中具有已知且稳定的电 极电势。 工作原理:在测量过程中,极化回路中有极化电流流过,可对极化电流进行 测量和控制。在测量控制回路中,可以实现对研究电极的电位进行测量和控 制。由于回路中没有极化电流流过,只有极小的测量电流,所以不会对研究 材料电化学复习提纲——ly 11 电极的极化状态以及参比电极的稳定性造成破坏。采用三电极体系,既可使 研究电极的界面上通过极化电流,又不妨碍对研究电极电极电位的控制和测 量,同时实现对电流和电位的测量和控制。 1.5 极化时电极电位误差的主要来源:在极化回路中,极化电流在溶液电阻(Ru)上产 生一个可观的电压降,溶液欧姆压降,其位于参比和研究电极之间,将附加在测 量电极电位上,成为测量误差的主要来源。 1.6 提高电极电位精度的措施 加入支持电解质,提高溶液导电性 使用鲁金管 1.7 参比电极:参比电极的性能直接影响着电极电位测量的稳定性、重现性和准确性。 不同场合对参比电极的要求不尽相同,应根据具体对象合理选择参比电极。参比 电极选用原则如下: 参比电极应为可逆电极,电化学反应处于平衡状态,可用能斯特方程计算不 同浓度时的电位值; 参比电极不易极化,以保证电极电位比较标准的恒定; 参比电极应具有较好的恢复特性 参比电极具有良好的稳定性:温度系数要小,电极电位随时间变化要小; 参比电极具有良好的重现性:热力学体系研究:0.02mV,动力学测试:不超 过 1mV 电极的制作、使用和维护简单方便 一般采用同种离子溶液的参比电极 1.8 标准氢电极:任何温度下标准电极电势都为 0;中毒的来源:溶液中含有氧化性 物质、溶液中含有易被还原的金属离子、铂黑界面吸附杂质。 1.9 电解质的选用 水溶液:理想的溶剂,大多数电化学过程都可在水溶液中研究,但是电化学 窗口有限 有机溶剂:可以溶解于水发生反应的溶质,电化学窗口比较大。但是易燃, 有毒性而且价格比较高。 熔融盐:高电导率、高稳定性、高电化学窗口 1.10 支持电解质的选用 溶解度要大,至少是电活性物种的 50-100 倍,是溶液中主要的导电物种电 势范围大,在实验范围内保持惰性 稳定性高,不与体系中的溶剂或电极反应有关的物质发生反应,且对电极表 面无特性吸附,不改变双电层结构 在有机溶液中使用,必须充分干燥、无水 1.11 电化学测量基本原则:控制实验条件,突出主要矛盾,使该过程在电极总过程中 占据主导地位,降低或消除其它基本过程的影响,通过研究总的电极过程研究这 一基本过程 2. 稳态测量方法 2.1 稳态:在指定的时间范围内,如果电化学系统的参量(如电极电位、电流密度、电 极界面附近液层中粒子的浓度分布、电极界面状态等)变化甚微或基本不变,这种 状态称为电化学稳态。稳态不等于平衡态,平衡态只是稳态的一个特例。稳态时 电极反应仍以一定的速度进行,只不过是各变量(电流、电压)不随时间变化而已, 而电极体系处于平衡态时,净反应速度为零 材料电化学复习提纲——ly 12 2.2 稳态系统的特点:电极界面状态不变;稳态电流全部用于电化学反应,极化电流 密度对应于电化学反应的速度;电极界面处的浓度不随时间变化。处于稳态扩散; 电极表面状态、电极真实表面积、溶液浓度及温度等条件在测试过程中都应保持 不变。 2.3 极化的种类和特点 电化学极化:由于电荷传递过程迟缓造成的界面电荷分布状态的改变,称为 电化学极化,其大小由电化学反应速度决定,与电化学反应本质有关。 浓差极化:由于扩散过程迟缓造成的界面电荷分布状态的改变,称为浓差极 化,其大小由扩散速度决定。 电阻极化:电流流过电极体系上的欧姆电阻时,会在电阻上引起欧姆压降, 称为电阻极化(欧姆极化),其主要由欧姆电阻决定,与溶液电阻率和电极间 距离有关。 2.4 稳态测试方法:电极达到稳态时进行电化学测试的方法 恒电势稳态测量:并不只是把电极电位控制在某一电位值不变,而是指控制 电极电位按照一定的规律变化。分为静电位法(逐点扫描)和动电位法(连 续扫描) 恒电流稳态测量:测量每个外测电流密度下的电位稳定值方法 恒电流法和恒电位法的选择根据具体情况而定,选择自变量,使得在每一个 自变量下,只有一个函数值。 为了测得稳态极化曲线,扫描速度必须足够慢。 稳态极化曲线反映的是电极电位或过电位与电流密度之间的关系曲线。测定 电极过程的极化曲线是研究电极过程动力学的一种基本的实验方法。 3. 暂态测量方法 3.1 暂态过程:当极化条件改变时,电极会从一个稳态向另一个稳态转变,要经历一 个不稳定的、变化的过渡阶段,这个阶段称为暂态。在暂态阶段,电极电位、电 极界面状态、扩散层的浓度分布都可能发生变化 3.2 暂态特点: 暂态具有暂态电流,极化电流分为两部分:用于电极反应的法拉第反应以及 材料电化学复习提纲——ly 13 用于给双电层充电的双层充电电流 在暂态下,电极附近液层中的反应离子浓度、扩散层厚度及浓度梯度等均随 时间变化,反应粒子浓度不仅是空间位置的函数,而且是时间的函数。 3.3 暂态方法的优点 暂态法适合研究快速电极过程,测定快速电极反应的动力学参数,能够大大 提高测量上限 对于快速电极反应,采用暂态方法,可以控制条件,使得电极表面附近反应 离子浓度基本不变,忽略浓差极化的影响。 暂态法可以研究反应产物在电极表面累积的情况,或者是电极表面在反应时 不断受到破坏的电极过程,稳态方法不行。 3.4 暂态过程分析方法:由于暂态系统是随时间而变化的,相当复杂,因此常常将电 极过程用等效电路来描述 电极过程的等效电路:总的极化电流等于双电层电容的双电层充电电流 ic 和流过反应电阻 Rct 的法拉第电流 if 之和 扩散过程的等效电路:浓差极化过电位的出现和增大是逐步的、滞后于电流 的 界面极化等效电路:界面极化过电位是由浓差极化过电位和电化学极化过电 位组成,扩散阻抗和反应阻抗应该串联 暂态过程等效电路:除了界面极化,还要考虑溶液电阻 材料电化学复习提纲——ly 14 四个电极基本过程:双电层充电、电荷转移、扩散传质和离子导电过程 3.5 暂态的分类:根据施加电信号的不同:控制电流、控制电位和控制电量方法;按 照极化方式的不同:阶跃法、方波法、线性扫描法和电化学阻抗法。 三、 化学电源 1. 化学电源分类 一次电池 二次电池 一次电池从严格意义上说也是可以充电的,但是循环性能很差而且安全性没有保障。国际上 通常认为循环性能 100 次以下的电池认为是 unchargeable battery, 100~500 次称为 renewable battery, 500 次以上为 rechargeable battery 二次电池用量越来越高,发达国家已经占到电池总用量的 60%以上,一次电池与二次电池相 比,能量密度、倍率性能等都差了很多,对环境的污染却更厉害。 2. 描述化学电源的基本参数 1、电动势 E = − ∆𝐺 𝑛𝐹 2、 内阻 R 3、 开路电压/工作电压(开路电压理论上为电动势) V = E − 𝜂+ − 𝜂− − I ∙ R 其中𝜂+、𝜂−分别为正负极过电压。 4、 电池容量与比容量 理论容量计算公式 𝐶0 = 𝑛F 𝑀 = 𝑛 ∙ 96500(𝐴 ∙ 𝑠/𝑚𝑜𝑙) 𝑀(𝑔/𝑚𝑜𝑙) = 26.8 ∙ 𝑛 𝑀 (𝐴 ∙ ℎ/𝑔) 实际容量为 C,C ≤ 𝐶0 5、 能量与比能量 电池储存的电能是电池反应 P,T 过程所做的最大非体积功,单位为 W·h 理论能量值为𝑊0 = 𝐶0 ∙ 𝐸,而实际的能量值为 W=C·V 比能量为单位中来那个或者单位体积所提供的能量 6、 功率与比功率 功率P = dW dt ,对恒流过程来说,C = I ∙ t,因此得到P = I ∙ V 比功率为单位重量或者单位体积提供的功率 7、 寿命与循环寿命 寿命通常用来描述一滴电池的存贮寿命(因为所有的电池都有自放电,通常要求一次电池在 20°C 温度下,存放两年容量保持在 90%以上) 循环寿命用来描述二次电池的循环性能。过充过放、温度、充放电电流等等因素对二次电池 循环寿命都有很大的影响,因此讨论二次电池循环寿命时要规定其使用温度、充放电电流、 过充过放等等因素。 电池的使用原则:浅充浅放,带电保存,保存时最好要有低温。 8、 倍率性能 有电流经过电极就会存在极化现象,大倍率放电通常会大大减小电池容量。 倍率性能常常用 C 来描述 材料电化学复习提纲——ly 15 C = 放电电流 标称容量 按照 C 值不同,通常把 1C 以下的电池称为低倍率型,1C~5C 为中倍率型,5C~10C 为高倍率 型,10C 以上为超高倍率型 9、 荷电保持率 电池自放电率与不可逆容量是不同的,自放电的损失是可逆的,而不可逆容量则是永久性的 损失。即使自放电率很低,但是若电池经过长期搁置,尤其是高温搁置之后,很容易引起不 可逆容量的损失。 影响荷电保持率的因素主要有以下三个: a. 隔膜的影响非常大(二次电池自放电率远大于一次电池) b. 经典理论认为原材料纯度影响很大 c. 负极容量过量越多,自放电损失越少。 3. 化学电源基本构成 1、 正极:活性物质+集流体 2、 负极:活性物质+集流体 3、 隔膜:要求有高的离子导电率,低的电子导电率 电解液:电解液的选取要注意与正负极材料兼容,要有比较宽的电化学窗口,要有比较好的 离子迁移率。当工作电压大于 1.23V 时,水会被电解,因此不可选用水溶液作为工作电压高 的电池电解液。锂离子电池通常选用有机电解质来作为电解液,但是这种电解液非常易燃, 存在很大的安全隐患。固体电解质电池的高倍率性能与低温性能很差,因为固体电解质的离 子扩散速率很 4. 化学电源基本设计原则 1、 氧化还原原则:一个电极发生氧化,另一个电极一定发生还原反应。 2、 电解液兼容原则:电解液要同时与两极发生反应。 3、 容量匹配原则:正极容量与负极容量的匹配,一般负极容量都远高于正极容量。 W = 𝐶0 ∙ 𝐸 E = 𝜑+ − 𝜑− 要提高电池能量储量,就应该有比较高的𝜑+与比较低的𝜑−,因此正极常常采用金属氧化物 或氢氧化物等,负极常用金属,因为金属易于氧化,故负极应当过量。负极过量可以对循环 寿命做贡献。但是限制锂离子电池寿命的是正极,故正极过量也是一种有前景的提高循环寿 命与电池容量的电池设计思路。 5. 化学电源设计中正负极活性材料的选用原则 1、 𝜑+越高越好,𝜑−越低越好 2、 容量,比容量都是越高越好。(在实际使用中体积比能量非常重要) 3、 在电解液中的结构稳定性要好 4、 电极活性材料的颗粒尺寸应当尽可能小,但是颗粒尺寸太小会导致体积容量下降,故常 用的电极活性材料颗粒尺寸在微米级别。 5、 对于可充电电池,不仅要在电解液中稳定,还要保证在循环过程中的稳定 6、 正负极材料要有尽可能好的导电性。 7、 负极材料要有比较好的电催化活性(过充电时被电解的电解液的重新合成就要求负极有 比较好的电催化性能) 材料电化学复习提纲——ly 16 8、 电极材料要有比较低的成本 6. 电池漏液的基本原因及其解决办法 电池内压太高,导致二次电池电解液流出,称为电池漏液。导致电池内压升高的根本原因是 水的电解产生大量的氧气和氢气。 解决办法 1、 尽可能让电池在可逆条件下工作,减小面积电流密度,可以增大正负极板尺寸,以减小 电流密度,降低极化。 2、 增大负极容量过剩(可以容纳被氧气氧化) 3、 提高负极催化活性(让 H,O 直接生成水),常用的方法有加入 Ni 等金属、减小负极颗粒 尺寸等 4、 提高析氧析氢电位(常常在正极材料中添加少量稀土氧化物等,细化负极材料颗粒尺寸 也可以提高析氧电位) 7. 产品选用原则以及化学电源的选择和应用 1、 安全性(比如电动汽车现在考虑用镍氢电池,车用电池考虑的方向:能量密度要能达到 500 公里不用充电以上;车用电池应当是若干个小电池的串并联组合;对单体电池的管 控、对电池组每一个电池电压的管控) 2、 技术性(先考虑安全性再考虑技术性) 3、 经济性 4、 环境兼容性 一次性电池的安全性通常比二次电池好。二次电池中锂离子电池安全性能最差。苛刻的条件 下使用锂离子电池要非常慎重,比如倍率性能要求非常高的时候使用锂离子电池要非常慎重。 高倍率放电性能方面,二次电池高倍率放电性能远大于一次电池。性能越差的电池倍率性能 越差。 自放电性能方面:一次电池自放电以年计算,二次电池自放电性能以月为单位计算。对自放 电性能要求高的场合肯定选用一次性电池 经济性方面:二次电池的一次性投入成本远大于一次电池。但是每个循环的费用,二次电池 远小于一次电池。在二次电池中,锂离子电池最贵,其次镍氢,再次镍镉电池,最便宜的是 铅酸电池。 环境兼容性方面,一次性电池污染最大;在二次电池中,铅酸电池污染最大,其次是镍镉电 池,再次是锂离子电池,最绿色的是镍氢电池。 8. 动力电池设计的基本思路 EV/HEV 对动力电池要求非常高。要求有很强的低温性能,很好的倍率性能,良好的高温 性能(荷电保持率要高) 设计动力电池最基本的出发点是尽可能的降低电池极化( V = E − 𝜂+ − 𝜂− − I ∙ R) 1、 减小电极处单位面积电流强度。增大正负极面积可以很大地提升电池高倍率放电性能。 2、 提高正负极的电化学反应的交换电流密度和极限电流密度。(交换电流密度和极限电流 密度是表征电池极化的重要的物理量)(常用的方法:a.细化活性物质的颗粒尺寸。b. 提高活性物质的导电性能。c.掺杂提高离子导电性。) 3、 负极活性材料容量适当过剩,可以降低倍率,提高倍率性能。 4、 提高电解液的离子导电性(增加添加剂等) 5、 提高隔膜的离子穿透率 材料电化学复习提纲——ly 17 6、 降低电池内电阻(活性材料涂层厚度越薄,内阻越低)
缩略图:
当前页面二维码





 工程招标采购
工程招标采购 搞笑表情
搞笑表情 微信头像
微信头像 美女图片
美女图片 APP小游戏
APP小游戏 PPT模板
PPT模板