材基二部分答案.pdf
- 文件大小: 350.77KB
- 文件类型: pdf
- 上传日期: 2025-08-23
- 下载次数: 0
概要信息:
习 题
第一章 相 平 衡
1. 图 1-1 示意表示出生成一个不一致熔融化合物 AmBn 和形成固溶体 SB(A)的二
元系统,试完成此相图的草图。
2. 对于图 1-2 所示的相图,试进行:(1)标出初晶区;(2)画出温度下降方向;
(3)确定相界线性质;(4)确定无变量点性质;(5)分析 1,2,3 点的结
晶过程。
(3)DP,PQ,EQ,GQ为低共熔线,FP为转熔线。
(4)E为低共熔点 L=B+C+S;P为转熔点 L+A=C+S。
(5)1 点组成物冷却先析出 A,液相点沿 A1 延长线运动至与 DP 相交,开始析出 C,
液相点沿 DP 向 P 运动,同时固相点沿 AC 向 C 运动;当液相点到达 P 时,固相点到达
P1 延长线与 AC的交点,P点发生转熔过程,固相点沿 P1延长线向 1点运动;液相消失
时,固相点到达 1点,结晶结束,得到 A,S,C三种晶体。
2 点组成物冷却先析出 A,液相点沿 A2 线向 FP 运动,到达 A2 线与 FP 的交点后
发生 A回吸,S析出,液相点沿 FP向 P运动,固相点从 A向 S变化;固相点到达 S时,
A 被回吸完,液相点到达 S2 延长线与 FP 的交点,随后液相点穿晶区向 GQ 变化,到达
S2 延长线与 GQ的交点后,液相点沿 GQ向 Q变化,固相点从 S向 F 变化;液相点到达 Q
后,发生低共熔过程,固相点沿 Q2延长线向 2运动;当固相点到达 2时,液相消失,
结晶结束,得到 B,S,C三种晶体。
3 点组成物冷却先析出 S,液相点沿 S3 向 GQ 运动,到达 S3 延长线与 GQ 的交点
后开始析出 B,液相点沿 GQ向 Q运动,同时固相点从 S向 G运动;液相点到达 Q点时,
固相点到达 Q3延长线与 AG的交点,Q点发生低共熔过程,固相点向 3运动;当固相点
到达 3点时,液相消失,结晶结束,得到 B,S,C三种晶体。
低共熔点
熔点
熔点 液相
A B AmBn
P
i j
k
l
f
d
○B
○S
○A
C
○A
○B c
b
A S B
1
2 3
E
a
e
g
h
○C
P
i j
k
l
f
d
○B
○S
○A
C
○A
○B c
b
A S B
1
2 3
E
a
e
g
h
○C
3. 对于图 1-3 所示的相图,试进行:(1)标出初晶区;(2)画出温度下降方向;
(3)确定相界线性质;(4)确定无变量点性质;(5)分析 1,2,3 点的结
晶过程。
(3)所有相界线均为低共熔线。
(4)所有无变量点均为低共熔点。
(5)1 点组成物冷却先析出 AC,液相
点沿(AC)1 的延长线向 OS 运动,到达
与 OS 的交点后,BC 开始析出,液相点
向 O 点运动,同时固相点从(AC)向 C 运
动;液相点到达 O 点时,固相点到达 O1
延长线与 AC 的交点,O 点发生低共熔
过程,固相点验 O1 延长线向 1 点运动,
到达 1 点时,液相刚好消失,结晶结束,
得到 AC,BC,AB 三种晶体。
2 点组成物先析出 BC,液相点沿(BC)2
的延长线向 OS 运动,到达与 OS 的交点
后,AC 开始析出,液相点向 O 点运动,同时固相点从(BC)向 C 运动;液相点到达 O
点时,固相点到达 O2 延长线与 BC 的交点,O 点发生低共熔过程,固相点验 O2 延长
线向 2 点运动,到达 2 点时,液相刚好消失,结晶结束,得到 AC,BC,AB 三种晶体。
3 点组成物先析出 AB,液相点沿(AB)3 的延长线向 OQ 运动,到达与 OQ 的交点后,
BC 开始析出,液相点向 Q 点运动,同时固相点从(AB)向 G 运动;液相点到达 Q 点时,
固相点到达 Q3 延长线与(AB)G 的交点,Q 点发生低共熔过程,固相点沿 Q3 延长线向
3 点运动,到达 3 点时,液相刚好消失,结晶结束,得到 AC,BC, B 三种晶体。
4. 某种陶瓷制品以长石 K2OAl2O36SiO2 和高岭土 Al2O32SiO22H2O 配料,在
1200
0
C 烧成。观察烧成制品的显微结构,发现由莫来石晶体和玻璃相组成,
问:(1)配料中,长石和高岭土各为多少?(2)制品结构中,莫来石和玻
璃相各为多少?
5. 氧化物 AO 和 SiO2 以一定配比混合成均匀的粉状配合物,加热至熔融状态,
并按不同方式冷却,所得的试样经过观察得到以下结果
冷却方式 观察结果
(1)迅速冷却
(2)熔融态保留1小时,在液相线以下80
0
C
保温 2 小时,然后淬冷
(3)熔融态保留3小时,在液相线以下80
0
C
保温 2 小时,然后淬冷
单相,无析晶迹象
表面有析晶,初晶相是 SiO2,还有玻璃相
表面有析晶,初晶相是 AOSiO2,同时有玻
璃相
f
A B
C
AC BC
AB
○C
○B ○A ○AB
○AC
○BC
e1 e2
e3
e4 e5
e6
E2
E3
E1
E
e
a
b
c
d
3
1
2
(4)熔融态保留 2 小时,迅速冷却到液相
线以下 200
0
C 保温 1 小时,在迅速冷
却至室温
没有析晶,但所得玻璃体呈雾状
请解释观察到的现象。
SiO2存在复杂的多晶转变。(1)快速冷却得到的是石英玻璃,(2)不平衡析晶析出 SiO2
(3)平衡析晶析出 AOSiO2,(4)产生分相。
6. 右图为含有一个三元化合物 D(AmBnCq)的三元系统相图,试判断:(1)图
中各界线的温度走向和性质;(2)该三元化合物是一致熔融还是不一致熔融
化合物?(3)确定各无变量点的性质;(4)分析图中 1、2、3 点的析晶过
程。
(1)PH为转熔线,其余界线为低共熔线。
(2) 该三元化合物是不一致熔融化合物。
(3)P为低共熔点 L=A+C+D;S为低共熔
点 L=C+B+D;H为转熔点 L+A=B+C。
(4)1点组成物先析出 A,液相点沿 A1延
长线向 FH运动,到达 A1延长线与 FH的交
点后,B开始析出;液相点沿 FH向 H运动,
同时固相点从 A向 F运动,液相点到达 H点
时,固相点到达 H1延长线与 AF的交点;H
点发生转熔过程,同时固相点沿 H1延长线向
1点运动,到达 1点时,液相消失,结晶结
束,得到 A,B,D三种晶体。
2点组成物先析出 A,液相点沿 A2延长
线向 GP运动,到达 A2延长线与 GP的交点
后,C 开始析出;液相点沿 GP 向 P 运动,同时固相点从 A 向 G 运动,液相点到达 P 点
时,固相点到达 P2 延长线与 AG 的交点;P 点发生低共熔过程,同时固相点沿 P2 延长
线向 2点运动,到达 2点时,液相消失,结晶结束,得到 A,C,D三种晶体。
3点组成物先析出 D,液相点沿 D3延长线向 SP运动,到达 D3延长线与 SP的交点后,
C 开始析出;液相点沿 SP 向 S 运动,同时固相点从 D 向 C 运动,液相点到达 S 点时,
固相点到达 S3延长线与 DC的交点;S点发生低共熔过程,同时固相点沿 S3延长线向 3
点运动,到达 3点时,液相消失,结晶结束,得到 B,C,D三种晶体。
7. 为什么在硅砖生产中 Al2O3 是很有害的杂质,而加入少量 CaO 能促进鳞石英
的形成而又不明显降低其耐火度。
根据 Al2O3-SiO2 系统相图,在 SiO2 - Al2S3 分二元系统中,纯 SiO2熔点为 1723度,低共
熔点靠近 SiO2一侧,液相线很陡,故加入 Al2O3到 SiO2后,熔点将急剧下降,使硅砖耐
火度大大降低,所以在硅砖生产中 Al2O3是很有害的杂质。
1
A B
C
S
e1
e2
e3
E1
E2
P
b
2
3
a
e
f
d
c
第二章 固 相 反 应
1. 镍(Ni)在 0.1 大气压的氧气中氧化,测得其重量增量(g)如下表:
温度 0
C
时 间
1hr 2hr 3hr 4hr
550 9 13 15 10
600 17 23 29 36
650 29 41 50 65
700 56 75 88 106
(1) 推导出合适的反应方程;(2)计算活化能
2. 试比较杨得方程、卡特方程和金斯特林格方程的优缺点及适用条件。
材料生产中通常采用粉状物料作原料,在反应过程中,颗粒间接触界面积不断变化。用
简单方法来测量大量粉状颗粒上反应层厚度很困难,故杨德在抛物线方程基础上采用了
“球体模型”,推导出了改进的动力学方程。杨德方程不能适用于反应程度大的情况。
卡特方程的特点是考虑了反应面积的变化及产物与反应物间体积密度的变化 ,因此比
杨德方程具有更好的适用性。
金斯特林格方程中,放弃了杨德假设中截面积不变的假设 ,反应物与产物的密度也不
同,反应前后体积变化,须引入由此带来的体积变化因素。金斯特林格方程具有很好的
适用性。
3. 为观察尖晶石的形成,用过量的 MgO 粉包围 1的 Al2O3 球形颗粒。在固定
温度实验中的第一个小时有 20%的 Al2O3 反应成尖晶石。试根据(1)无球
形几何校正;(2)用杨得方程作球形校正,计算完全反应的时间。
(1) 由 x
2
=Kpt,则 x=0.2 时,t=1h;故 x=1时,t=25h.
(2) x
2
=Kpt,其中 x=R0[1-(1-G)
1/3
],则 G=0.2时,2t=1h;故 G=1时,t=194.6h.
4. 要合成镁铝尖晶石,可供选择原料为 MgCO3、Mg(OH)2、MgO、Al2O33H2O、
-Al2O3、-Al2O3。从提高反应速率角度出发,应选择什么原料?
选用 MgCO3和 Al2O33H2O
同一物质处于不同结构状态时,其反应活性差别很大。晶格能越高,结构越完整和稳
定,其质点可动性小,反应活性越低。对于难熔氧化物间的反应和烧结往往是困难的,
通常采用具有高活性的活性固体作原料,利用热分解反应和脱水反应,形成具有较大
比表面积和晶格缺陷的初生态或无定形物质等措施来提高反应活性,是促进固相反应
进行的一个有效手段。
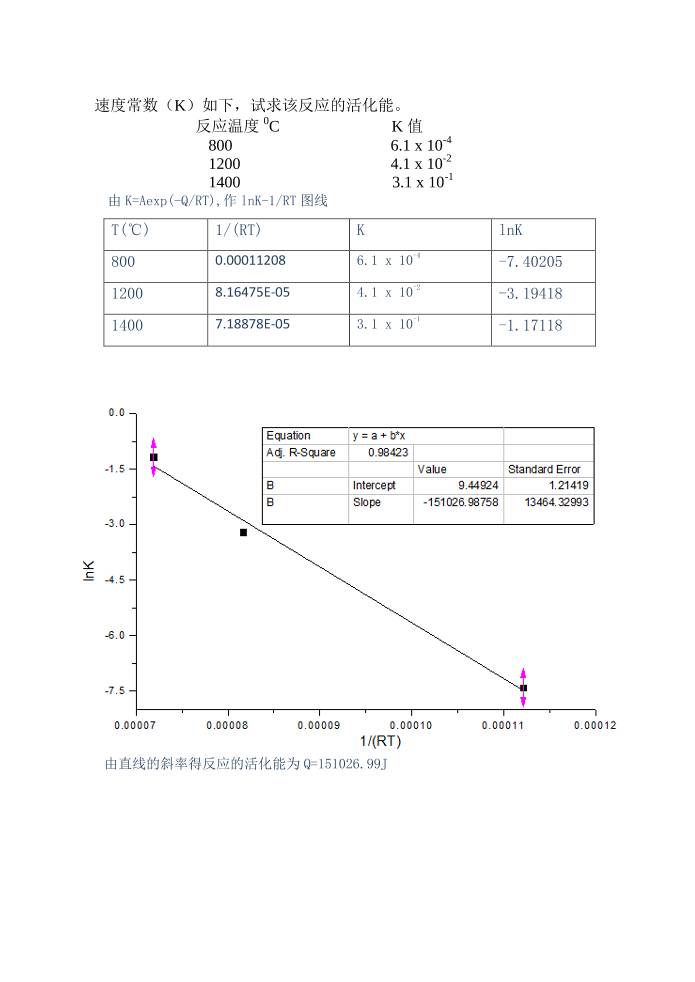
5. 设固相反应 CaO+SiO2=2CaOSiO2 符合杨得方程,并测得不同温度下的反应
速度常数(K)如下,试求该反应的活化能。
反应温度 0
C K 值
800 6.1 x 10
-4
1200 4.1 x 10
-2
1400 3.1 x 10
-1
由 K=Aexp(-Q/RT),作 lnK-1/RT图线
T(℃) 1/(RT) K lnK
800 0.00011208 6.1 x 10
-4
-7.40205
1200 8.16475E-05 4.1 x 10
-2
-3.19418
1400 7.18878E-05 3.1 x 10
-1
-1.17118
由直线的斜率得反应的活化能为 Q=151026.99J
第三章 烧 结 过 程
1. 烧结的推动力是什么?晶体生长的推动力是什么?试比较两者的大小。
伴随表面积减少的烧结过程是一个自发的不可逆的过程,而推动系统表面积减少的自
由颗粒表面的表面张力则是本征的或基本的烧结推动力;
晶体生长的推动力是晶界过剩的表面能。
烧结推动力要大于晶体生长推动力:界面或表面向曲率中心移动的过程中,在晶体生长
过程中界面会受到来自前方的阻力,而烧结过程界面所受来自前方的阻力则很小。
2. 烧结过程中,晶粒生长能使陶瓷致密吗?为什么?晶粒生长能影响烧结速率
吗?为什么?
3. 在 1500
0
CMgO 正常晶粒长大期间,观察到晶体在 1 小时内从 1m 直径长大
到 10m。已知晶界扩散能为 60Kcal/mol,试预测在 1600
0
C 下 4 小时后晶粒
的大小。你估计杂质对 MgO 晶粒生长速率会有什么影响,为什么?
k=Aexp(-Q/RT)
D
2
-D0
2
=kt
T1=1773.15K,T2=1873.15K; t1=1h, t2=4h,D0=1μ m; D1=10μ m
由 D0=1μ m; D1=10μ m;t1=1h得 k1=99
进一步得 k2=245.73
D2
2
=D0
2
+k2t2=983.9
D2=31m
引入杂质会阻碍晶界移动,使晶粒正常长大停止,影响晶粒长大速率,也会是晶粒长大
过程的结束。
4. 试解释下列名词:(1)熔融温度,烧结温度;(2)烧结与烧成;(3)液相烧
结与固相烧结;(4)晶粒生长与二次再结晶。
(1)熔融与烧结:都是由原子热振动使原子间联系减弱引起的;熔融要在熔点以上,
烧结温度要低于熔点:金属的泰曼温度为 0.3~0.5Tm,硅酸盐的为 0.8~0.9Tm,盐类的
为 0.57Tm。
(2)烧结与烧成:烧成包括多种物理和化学变化,而烧结只晶粒一系列较为简单的物
理变化;烧成包括烧结。
(3)液相烧结与固相烧结:均在熔点以下进行,且自始至终至少有一相处于固态;固
相反应至少有两个组元且发生化学反应,而烧结可只有一个组元,不发生化学反应。
(4)晶粒生长与二次再结晶:晶粒长大:通过晶界移动(晶界由弯曲变平直,而非晶
粒互相粘结)胚体中的一部分晶粒长大(对应一部分晶粒缩小或消失),其推动力是晶
界过剩表面能;二次再结晶:导致晶粒长大的晶界移动可能被夹杂物或气孔阻碍而静
止,但一些边数特别多、晶界能特别大的晶粒可越过这些阻碍进一步反常长大并吞并
周围其他晶粒;其推动力是大晶粒的表面能。
5. 有两个相同试样分别加热到 600
0
C 和 700
0
C,第一个试样加热到 600
0
C 经过
30 小时后其晶粒从 0.05mm 增加一倍变化到 0.10mm,第二个试样加热到
700
0
C 发生同样变化用了 30 分钟,试问加热到 750
0
C 时晶粒尺寸发生这样的
变化需要多少时间?
U=U0exp(-E/RT) 又 D=UΔ t
D相同时,T1=873.15K,T2=973.15K; Δ t1=30h, Δ t2=0.5h,解得-E/R=-34787
当 T=1023.15时,Δ t=0.087h
第四章 熔融态与玻璃通性
1. 试用 lg=E+F/(T-T0)方程式,绘出下列两种熔体在 1350
0
C ~500
0
C 间的粘度-
温度曲线(lg~1/T):
E F T0
No.1 1.631 4229 219
No.2 1.769 4690 216
2. 一种熔体在 1300
0
C 的粘度是 3100 泊,在 800
0
C 是 10
8 泊,在 1050
0
C 时其粘
度是多少?在此粘度下急冷,是否形成玻璃?
ln3100=A+B/1573.15
ln10
8
=A+B/1073.15
解得 A=-14.24 B=35052.71
故 lnη =-14.24+35052.71/T
当 T=1050℃时,η =2.09×10
5
泊
因η <10
13
泊,故可形成玻璃。
3. 决定玻璃熔体中复合阴离子团大小和结构的主要因素是什么?试从熔体结
构概念比较以下玻璃成分的粘度大小顺序:
玻 璃 成 分
SiO2 Al2O3 CaO Na2O
1 75 0.5 8.5 16.0
2 75 2.0 8.0 15.0
3 75 2.0 9.0 14.0
决定玻璃熔体中复合阴离子团大小和结构的主要因素是氧化物的含量不同;
CaO、Na2O为网络改变体,可以降低玻璃的粘度,因Na2O的作用较大,故粘度大小:1<2<3。
4. 实验获得 Na2O-Al2O3-SiO2 和 Na2O-B2O3-SiO2系统玻璃的分子体积随组成中
R2O3 含量变化如下图,试解释其原因。
B2O3:B2O3 含量较少时,处于[BO4]四面体状态,粘度增加,分子体积减小,当 B2O3 与
Na2O含量比达 1:1 时粘度达到最大值;然后 B2O3含量继续增加,部分[BO4]四面体变为
[BO3]三角体,结构疏松,粘度降低,分子体积增大。
Al2O3:一般以[AlO6]八面体存在,但有碱金属氧化物或碱土金属氧化物存在时呈[AlO4]
配位,与[SiO4]连成复杂的负离子团使粘度增加,分子体积减小;而当这两种氧化物
提供的自由氧被 Al2O3用光时,粘度降低,分子体积增大。
5. 试述石英晶体、石英熔体、Na2O2SiO2 熔体结构的区别,如何用实验方法区
分它们?
石英晶体的结构特点是构成晶体的质点在三维空间作有规则的周期排列,呈现远程有
序;而石英熔体、Na2O2SiO2熔体都属于非晶体,呈现近程有序远程无序。
先对三种试样作 X射线散射,有尖锐衍射峰的是石英晶体,出现馒头峰的是石英熔体、
Na2O2SiO2熔体,再对出现馒头峰的试样做电导率测试,电导率高的是 Na2O2SiO2熔体,
电导率低的是石英熔体。
28
27 Al2O3
26
25 B2O3
0 8 16 24 32
R2O3 mol%
分
子
体
积
cm
3
/mol
6. 如右图所示同一组成的玻璃经退火处理(a)和急冷(b),两种试样测得的膨胀
曲线,两者明显不同,试说明原因。
急速冷却得到的是淬火玻璃,熔体在较高的温度偏离
平衡结构,把原来疏松的结构保持下来;而缓慢冷却
得到的退火玻璃,熔体在较低的温度偏离平衡结构,
把紧密的结构保持下来。所以在加热膨胀,温度较低
时,淬火玻璃的疏松结构较退火玻璃的紧密结构有较
大的膨胀性能,但在高温下,退火玻璃有较好的膨胀
性能。
7. 试比较下列玻璃在某一温度下的粘度大小,并说明原因。玻璃成分如下表所
示
玻璃 SiO2 Na2O CaO MgO BaO
1 82.0 18.0 - - -
2 78.0 18.0 4.0 - -
3 78.0 18.0 - 4.0 -
4 78.0 18.0 - - 4.0
解:将 1 看作是 78.0%SiO2+18.0%Na2O+4.0% SiO2
则 4种成分相当于 1中加入 4%的网络形成体 SiO2,有增大粘度的作用;2、3、4中都加
入的是碱土金属氧化物,降低粘度的顺序:BaO> CaO> MgO;故最终的粘度大小:1>3>2>4。
急冷试样
经退火试样
温度缩略图:
当前页面二维码





 工程招标采购
工程招标采购 搞笑表情
搞笑表情 微信头像
微信头像 美女图片
美女图片 APP小游戏
APP小游戏 PPT模板
PPT模板