9.pdf
- 文件大小: 805.88KB
- 文件类型: pdf
- 上传日期: 2025-08-21
- 下载次数: 0
概要信息:
材料表面与界面
上节课主要内容
• TiO2的光催化作用
• TiO2 表面的亲水亲油性
• 偏析和耗尽
• 平衡偏析与非平衡偏析
• 内外表面偏析及对材料性能的影响
第一节 吸附和偏析
(c) 晶界偏析
• 在研究了电子束蒸发的Ni-Cr薄膜,发现它具有
负电阻温度系数特性。
产生这一现象的原因是氧在晶界处发生了偏析,
并与铬化合生成非晶态的氧化铬。
氧化铬是绝缘体,当它有足够的厚度,并且在
晶界处作连续分布时,对传导电子来说是一个
势垒区,电子只能通过热电子发射,或者热激
发隧道效应才能通过这个势垒区
第一节 吸附和偏析
当Ni-Cr薄膜热处理后,薄膜能使Ni-Cr转变成
正电阻温度系数特性。
转变的原因:
未热处理前,Ni-Cr固溶体的晶粒尺寸为
5~10nm;氧化铬完整地包裹着晶粒表面。
经热处理后,晶粒尺寸长大可达1µm左右,
偏析的氧化物凝集成第二相,呈不连续绝缘膜,
使Ni-Cr晶粒间能相互连接,故TCR为正。
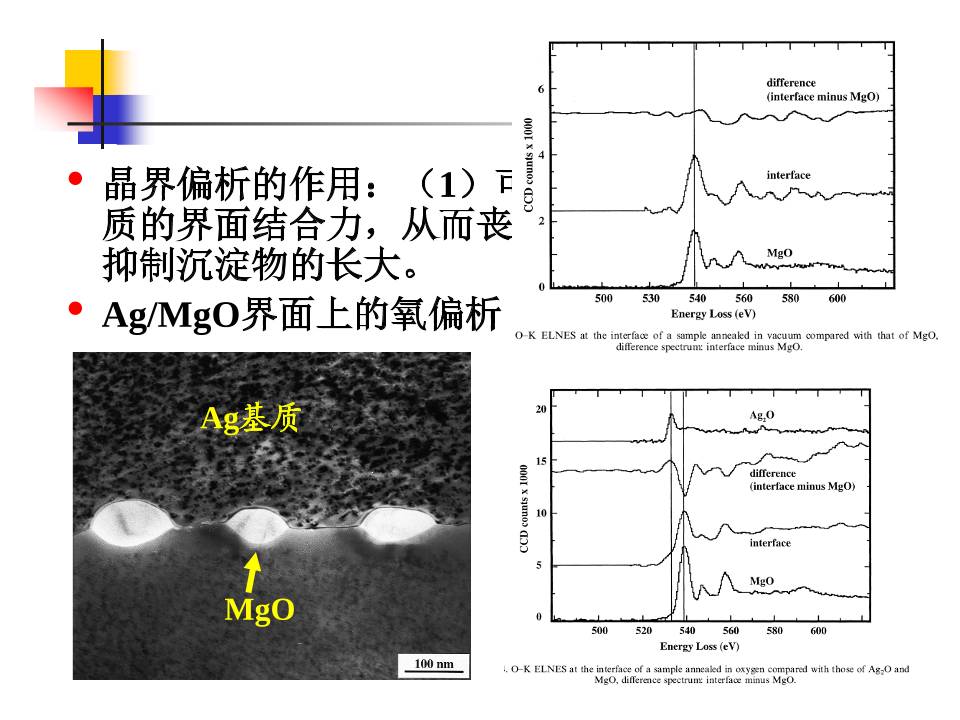
• 晶界偏析的作用:(1)可能会弱化对沉淀/基
质的界面结合力,从而丧失延展性。(2)会
抑制沉淀物的长大。
• Ag/MgO界面上的氧偏析
Ag基质
MgO
第二节 表面扩散和界面扩散
第二节 表面扩散和界面扩散
2.1 扩散规律和机理
• 扩散是材料中存在有浓度梯度时产生的原子定
向运动。
(1) 扩散定律
• 费克第一定律是联系扩散流(通量)和浓度梯度
dC/dx间关系
dx
dCDJ −=
kTQkTE eDeDD /
0
/
0
−− ==
D为扩散系数
D0称为与温度无关的频率因子, E、Q称激活能。
第二节 表面扩散和界面扩散
• 费克第一定律是稳定态情况,即在扩散过程中
各处的浓度梯度下随时间而变。
• 实际上随着扩散过程的进行,各点浓度会随时
间而变。根据扩测定质浓度变化,可得Fick第
二定律:
=
dx
dCD
dx
d
dt
dC
若D与浓度无关,费克第二定律为
2
2
dx
CdD
dt
dC
=
第二节 表面扩散和界面扩散
(2) 扩散机理
• 在固体中原子扩散, 主要通过原子利用缺陷位
置进行运动。如填隙原子、空位和原子团互换
位置。
• 扩散能力可以用扩散系数代表。其表达式为:
)/exp(2 RTQAalD −= ν
上式中ν为原子振动频率, l为缺陷跳跃的平均距离,
A为一个与温度和原子浓度有关的系数, a 为一参数
(一维扩散为1/2,二维扩散为1/4,三维扩散为1/6)。
第二节 表面扩散和界面扩散
(3) 几种扩散的比较
• 原子的扩散运动与缺陷是密切相关,相应有体
扩散、表面扩散和界面(晶界)扩散等三种类型。
)/exp(2 RTQAalD −= ν
原子通过缺陷运动的激活能较体内小: Qsνb>νl
体内原子间相互作用力大,跳跃距离ll 小(~晶格常
数量级), 在表面和界面,相互作用力小,跳跃有较
大的空间,故ls>lb>ll 。
•同一种成分的材料,在平衡状态时,Ds>Db>Dl。
第二节 表面扩散和界面扩散
2.2 表面扩散
• 表面扩散是指原子沿着表面区内的物质输运。主
要发生在距表面2~3层原子面的范围。
(1) 表面扩散的主要特征
• 表面原子作局域扩散、非局域扩散和处于蒸发状
态下的能量。
第二节 表面扩散和界面扩散
• 通过以上分析,可以看出,表面扩散和体内扩
散的一个主要区别是,表面扩散时,原子可能
逃逸到固体表面上的三维空隙位置后进入另一
个新位置。
第二节 表面扩散和界面扩散
(2) 表面扩散的种类
(a)由于原子浓度梯度引起的表面扩散
(b)由毛细管作用力引起的表面扩散
• 毛细管作用可以作为表面扩散的一种驱动力。
粉体烧结、粒子聚结、晶界沟漕等都是由于毛
细管作用所引起。
第二节 表面扩散和界面扩散
• 刚开始时, 两晶粒表面为平面,
晶界面也是平面, 与表面垂直。
晶界界面张力为γb, 它的作用
是使晶界尽量缩小。
• 平衡时, γb = 2γssinθ γs是固-气
表面张力, θ为夹角
抛光和热蚀
第二节 表面扩散和界面扩散
(3) 各种材料的表面扩散
(a) 金属表面的扩散
• 熔点高于衬底(基体)材料熔点的杂质(高内
聚能),能使自扩散系数Ds减小;熔点低于衬
底材料的杂质,可能使Ds增大,通常其增加
的量值取决于杂质的覆盖度。
第二节 表面扩散和界面扩散
(b) 金属氧化物和碱金属卤化物表面扩散
• Al2O3中含有少量的Si和Ca时,这两种杂质会在
自由表面上分凝出来,形成一个低熔点薄层,使
表面扩散系数Ds增大。
• 碱金属卤化物的表面扩
散 激 活 能 很 低 , 在
3~16kcal/mol之间。可以
认为正、负离子几乎有
相同的激活能。在扩散
过程中正负离子会交替
跳跃,形成中性分子扩
散。
第二节 表面扩散和界面扩散
Cl2在TiO2表面扩散
第二节 表面扩散和界面扩散
2.3 晶界扩散
(1) 晶界扩散的动力学模型
• 根据晶界扩散与体扩散之间的关系,晶界扩散可
分为A、B、C三种典型模型。
A型:
常出现在高温、长时间退火、小晶粒的场合下。
体扩散长度(Dt)½ 大于晶粒尺寸(d)
晶粒中扩散很快,晶界扩散更快,两种扩散混合
起来,基本上可看作“均匀”地往体内渗透。
动力学条件:(Dt) ½ 》d
第二节 表面扩散和界面扩散
有效扩散系数(Deff)
Deff = fDb + (1-f)D,
f为晶界的体积分数。
f=qδ/d, q为数值因子并取决于晶粒形状,如平行
晶界, q=1。
由于Db》D,Deff通常大于D。所以多晶的扩散系
数常大于D。
如果d非常小,Deff主要取决于fDb, 即Deff≈ qδDb/d
第二节 表面扩散和界面扩散
晶粒中扩散较慢,晶
界扩散甚快,扩散
的结果是晶界附近
“包”上一层杂质。
B型:
常出现在较低温度、退火时间短、大晶粒的场合下
体扩散长度:sδ《(Dt)½ 《d,s为平衡偏析因子
最常见的晶界扩散情形
第二节 表面扩散和界面扩散
杂质只能通过晶界向
内部渗透,体内几
乎没有。
C型:
如果比B型更低的温度、或更短的退火时间。
体扩散长度:(Dt)½ 《 sδ ,s为平衡偏析因子
这样的扩散情形可以测出晶界扩散系数
第二节 表面扩散和界面扩散
2.4 界面扩散
(1) 柯肯达尔扩散
• 立方黄铜表面放置很细的钼丝,
再电镀纯铜,使钼丝包围在铜
和黄铜之间。
• 在785℃温度下保温一天后,
钼丝向黄铜“内移”0.0015cm,
保温56天后,则钼丝“移动”
达0.0124cm,即铜-黄铜界面向
外侧发生了移动,产生此种效
应的扩散称柯肯达尔扩散。
第二节 表面扩散和界面扩散
•黄铜是铜和锌的合金,黄铜中的锌通过界面外部
扩散,而铜则往黄铜扩散。
当两种原子在互扩散时,通常是熔点低、质量轻
的原子扩散速度快,所以黄铜中锌向铜中的扩散
比铜往锌中扩散快。故铜-黄铜界面会出现不断移
动现象。
第三节 金属和合金的氧化
第三节 金属和合金的氧化
• 在金属和合金表面: 一般都有一层氧化层。起
着保护作用,也可能是腐蚀的生成源。
• 氧化层大部分是自然生长的,也有通过人工
生长的(如阳极氧化、热氧化等)。
第三节 金属和合金的氧化
3.1 氧化作用
• 金属与原子或原子团结合并失去电子时,称
氧化反应。
xMe + y1/2O2 ⇔MexOy
• 一般氧化物形成趋势很大,并且很稳定。
• 如氧化镍,对应的分解气压为1.2×10-13乇,
这已经是超高真空的范围了。
第三节 金属和合金的氧化
3.2 金属的氧化
(1) 氧化初期
(a) 吸附和交换位置
• 首先氧分子吸附,同时发生也有解吸。
• 吸附氧的表面是重构的,金属在其原先的晶
格位置,氧原子则处在一些固定位置。
• 随着吸附的覆盖度增大,在金属表面形成规
则的二维氧原子(或氧分子)层。
第三节 金属和合金的氧化
• 由于氧有很强的电负性,在许多清洁金属的
表面是不需要激活能的化学吸附,金属和氧
离子间的键是离子性的。
•对于许多金属来说.只是在较低
温和低覆盖度下才是纯化学吸附。
•当温度升高和氧覆盖度增大时,
氧与金属原子会相互交换位置、氧
进入金属的表面层,这时称生成了
赝氧化物。
第三节 金属和合金的氧化
(b) 成核
• 氧化初期中产生M和O发生交换位置的区域
(赝氧化物),没有形成新相。
• 氧化过程涉及到新相核形成和长大过程。但
在表面氧化中,核有时可认为比较小。
• 表面上的杂质对氧化过程有重要影响。 硫会
阻止铁的氧化。可能与硫阻止铁与氧交换有
关。
• 氧分压高,温度高,临界相核尺寸小,氧和
金属的活动能力都很大。在清洁表面易瞬间
生成很薄的一层氧化膜。
第三节 金属和合金的氧化
(2) 氧化物的长大及其规律
• 新相成核以后,就以二维或三维形式生长。
当氧化物厚度达几百到几千埃时,已能清晰
地将其与金属分开,这已是后期。
• 一些氧化物膜长到一定厚度就基本停止生长
(如A1、Ta、Pt、Si等),而另一些(Fe,Mg等)
则不断生长呈鱼鳞状。
第三节 金属和合金的氧化
(a) 氧化物的形态
• 氧化态:氧化过程主要受动力学控制。
Cu:热力学判据CuO比Cu2O要稳定。但实
际上表面是Cu2O。
靠近金属处,氧化物中金属的比例要大一
些,呈化学计量或非化学计量。
• 原子排列有序性:表面氧化物的结构也会因
外界条件而变。
铝:低于425℃,表面生成非晶态的氧化铝;
在高温时,生成晶态γ-Al2O3;
第三节 金属和合金的氧化
(b) 氧化物的长大规律
• 氧化物膜层长大时,可以按照下面的规律生长:
线性律 x = k1t
抛物线律 x2 = k2t
立方律 x3 = k3t
对数律 x = k4ln(kst + t0)
反比对数律 1/x = k6 – k7lnt
式中x是氧化物平均厚度,t是氧化时间,k1~k7以
及t0均为常数。由于氧化物实际上是非均匀生长,
x是平均厚度。
第三节 金属和合金的氧化
• 与温度的关系:低温下,氧化物生长规律是
对数律;温度上升时,生长规律逐步变成立
方体、抛物线体直到直线律。不同金属氧化
物的生长规律的转变温度并不相同。
• 与生长形态的关系:很薄的氧化膜按照对数
律增长;中等厚度的氧化膜按抛物线律增长:
较厚的或鱼鳞状氧化膜按线性律增长。
第三节 金属和合金的氧化
(3) 氧化物生成的扩散模型
• 氧化物新相(晶)核生成之后,它的长大要靠扩散才
能进行。实际上扩散包括了体扩散和晶界扩散两种。
• 在氧化物层长大过程中, 氧离子往内扩散,金属离子
也要向外扩散。
第三节 金属和合金的氧化
• 随着氧化物层厚度增加,空位的积累,会形成空洞,
引起较大畸变能, 造成氧化膜破裂 (如氧化铁) 。
第三节 金属和合金的氧化
• 电子转移:金属首先电离后再穿过氧化层去和O2
-、
O2
2-、O-或O2-等发生反应,同时发射出一个自由
电子。同理氧则先电离化成各种电离态,穿过氧
化层与电离的金属离子反应,同时发射一个空穴。
第三节 金属和合金的氧化
3.3 合金的氧化
• 对于AB合金,如溶剂A不断氧化为AO相,会引起溶
质B富集。在一定程度下,B也开始氧化,并逐步
产生BO相。
• 如BO是附着性良好膜存在于AO 表面,则随后的
氧化取决于A离子和氧离子在BO中的渗透性。
• 若B元素对氧的亲合性比A元素高,则会逐步形成
BO的外表面,AO就在内层。要是BO具有挥发性,
虽然它氧化得快,但最终的表面仍是AO。
• 若BO形不成完整的膜,则AO就不断的扩大,最终
的表面由含有BO小岛的AO组成。
第三节 金属和合金的氧化
• 溶质氧化物与溶剂氧化物间可以互溶,也可以
产生反应,如氧化铝和氧化亚铜、氧化铜之间
发生的反应
Al2O3 + Cu2O = 2CuAlO3
Al2O3 + CuO = 2CuAl2O4
第三节 金属和合金的氧化
• 如氧化物间不能互溶,互扩散也受限制,那么易形
成双层氧化物。
NiCr合金:Cr氧化物生长速率较Ni氧化物快。
如Cr含量少于10%时,在Cr2O3内层上形成NiO;
如Cr含量为25%时,Cr2O3呈为外层,在内层NiO
很少或甚至没有。
Ni-20%Cr合金的扫描俄歇微区分析和光电子能谱
分析表明,800℃的氧化时,Cr2O3晶粒表面生成一
层500nm的NiO,所有合金的晶界上有一层100nm
宽,200nm厚的Cr2O3。 缩略图:
当前页面二维码






 工程招标采购
工程招标采购 搞笑表情
搞笑表情 微信头像
微信头像 美女图片
美女图片 APP小游戏
APP小游戏 PPT模板
PPT模板